L’hépatite virale E: Résultats d’investigations préliminaires chez la poule pondeuse et la poule reproductrice
Résumé
L’hépatite virale E aviaire (AHVE), encore appelée maladie du gros foie et de la grosse rate, Big Liver and Spleen disease (BLS) est due à un Hepevirus de la famille des Orthohepevirus. Elle se manifeste par une mortalité brusque chez la poule pondeuse et la poule reproductrice, associée à une chute de ponte sans dégradation de la qualité des œufs. Elle est d’apparition récente et a été rapportée dans quelques pays seulement dont les USA, le Canada, l’Espagne, la Hongrie, la Chine et la Pologne. Depuis quelques années, des mortalités brusques pouvant atteindre 0.3% par semaine et des chutes de ponte pouvant aller jusqu’à 12-15 % ont constitué régulièrement des motifs de consultations. Le diagnostic lésionnel macroscopique n’est pas évident en raison de la similitude des lésions observées sur le foie avec celles rencontrées dans le cas des stéatoses hépatiques, pathologie avec laquelle le diagnostic différentiel s’impose. Les lésions trouvées généralement consistent en une hépatomégalie avec présence ou non d’une stéatose, cependant les hémorragies sont toujours constantes avec une splénomégalie variable. Le présent travail se rapporte à des investigations préliminaires réalisées sur plusieurs cas de poules pondeuses et de reproductrices présentant les symptômes et lésions précitées. Outre les aspects épidémiologiques et lésionnels macroscopiques observés, les investigations ont porté sur l’analyse des résultats des examens anatomo-pathologiques, des sérologies Elisa réalisées sur des sérums provenant des élevages concernés, de même que la réalisation sur les foies et rates d’animaux atteints de tests de PCR en temps réel spécifiques à cette pathologie. Parallèlement, une étude séro-épidémiologique a porté sur un échantillon de 9255 sérums prélevés durant les années 2017 à 2020. Les résultats préliminaires sont mitigés mais pointent davantage sur la nécessité d’élargir le champ d’investigation en développant les outils de diagnostic sérologiques et moléculaires plus spécifiques au contexte épidémiologique marocain. Cette étude rapporte les premières descriptions de la pathologie au Maroc.
Mots clés: Hépatite virale E, Stéatose hépatique, anatomopathologie, RT-PCR, ELISA
INTRODUCTION
L’hépatite virale E (HVE), encore appelée maladie du gros foie et de la grosse rate ou «Big Liver and Spleen disease» (BLS), est due à un Hepevirus de la famille des Orthohepevirus (Huang et al., 2004) et qui est apparenté aux virus des hépatites E humaines et porcines (Emerson et Purcell, 2003; Sun et al., 2019). Elle se manifeste par une mortalité brusque chez la poule pondeuse et la poule reproductrice, associée à une chute de ponte sans dégradation de la qualité des œufs. Elle est d’apparition récente et a été rapportée dans quelques pays seulement dont les USA, le Canada, la Hongrie, l’Espagne, la Chine et la Pologne (Ritchie et Riddell, 1991; Shivaprasad, 2003; Agunos et al., 2006; Morrow et al., 2008; Priscilla et al., 2013; Zhao et al., 2013; Matczuk et al., 2018).
Depuis quelques années, des mortalités brusques pouvant atteindre 0,3% par semaine et des chutes de ponte pouvant aller jusqu’à 12-15 % ont constitué régulièrement des motifs de consultations dans des élevages de poules pondeuses et de poules reproductrices dans plusieurs régions du Maroc. Les lésions généralement trouvées consistaient en une hépatomégalie, des hémorragies/ruptures des foies avec présence ou non d’une stéatose et une splénomégalie variable. La suspicion de l’HVE a été considérée mais son diagnostic lésionnel macroscopique n’était pas évident en raison de la similitude des lésions observées sur le foie avec celles rencontrées dans le cas des syndromes stéatoses/hémorragies hépatiques, pathologie avec laquelle le diagnostic différentiel s’impose.
Afin d’élucider ces cas, des investigations histopathologiques, sérologiques et moléculaires ont été réalisées. Ainsi, le présent travail a pour objectifs de présenter les résultats des investigations préliminaires réalisées sur plusieurs cas de poules pondeuses et de reproductrices présentant les symptômes et lésions similaires à celles induites par l’HVE, de même que les résultats d’une enquête séro-épidémiologique réalisée sur des sérums provenant d’élevages de reproducteurs type chair de 2018 à 2020.
MATÉRIEL ET MÉTHODES
Historique clinique et prélèvements
L’étude a concerné un total de 14 élevages provenant des principales régions de production avicole. Les cas-élevages décrits ont tous étés suspectés, durant la période 2019-2020, être des cas d’hépatite E suite aux lésions trouvées à l’autopsie, essentiellement des crêtes pâles, des ruptures du foie avec ou sans splénomégalie et une régression de la grappe ovarienne pour les poules provenant d’élevage ayant fait une chute de ponte.
Après autopsies, des prélèvements d’organe (foie et rate) à partir de 3 sujets par élevage ont été effectués en vue des investigations histopathologiques et moléculaires (RT-PCR) pour la recherche du HVE. Certains des 14 élevages ont été revisités pour expliciter davantage le contexte épidémiologique. Aussi, des sérums ont été prélevés à partir d’oiseaux d’élevages suspects atteints pour les analyses sérologiques par ELISA. Le tableau 1 résume la répartition des principales investigations effectuées au sein des élevages étudiés.

Examens histo-pathologiques
Des fragments de foies et de rates de poules naturellement décédées (3 sujets de chaque élevage affecté) ont été prélevés et fixés dans du formol tamponné à 10%. Les tissus ainsi fixés ont été préparés selon les techniques histologiques usuelles par inclusion à la paraffine. Des coupes de 5µm ont été préparées, puis colorées par la technique hématoxyline & Eosine et par la technique au Rouge Congo. Les coupes montées entre lame et lamelle ont été examinées au microscope optique en vue de la recherche de modifications pathologiques microscopiques au niveau des foies et rates issus des différents élevages concernés. Les changements recueillis ont été consignés sur une base de données et comparés.
Analyses sérologiques (ELISA) réalisés sur les cas cliniques pour la recherche des anticorps HEV
Quinze prélèvements de sang ont été réalisés à partir des poules de chacun de 7 élevages de pondeuses et 3 de reproducteurs chair (Tableau 1). Les prélèvements ont été effectués au moins 2 semaines après l’apparition des symptômes dans les troupeaux. Les échantillons ont été analysés vis-à-vis des anticorps de l’Hépatite E au moyen de kit commercial BLS ELISA Kit (BioChek, Berkshire, United Kingdom) selon la procédure indiquée par le fabricant. La lecture de l’absorbance a été réalisée sur un lecteur ELISA (Tecan SLT Spectra,, Swizerland).
Enquête séro-épidémiologique
Parallèlement aux investigations sérologiques réalisées sur les cas cliniques, il a été procédé à l’analyse de sérums provenant de reproducteurs type chair et d’élevages de poules pondeuses basé sur un sondage. Pour le calcul de l’échantillonnage épidémiologique de 9255 prélèvements répartis comme suit: 3114 (année 2018), 5971 prélèvements de l’année 2019 et 819 prélèvements de l’année 2020 ciblant toutes classes d’âge et les deux types de productions. Afin d’éviter les biais de la sélection et par conséquent permettre l’extrapolation des résultats, le tirage au sort simple et aléatoire utilisé est à deux degrés: le groupe et le nombre de sérums (unité). Ainsi, le calcul de la taille de l’échantillon a été basé sur une prévalence apparente de 0,5, une précision estimée de 0,05 et un intervalle de confiance de 95%. Le calcul et le tirage au sort aléatoire et représentatif ont été effectués à l’aide du logiciel Survey Toolbox donnant ainsi 334 sérums (unités) à analyser provenant de 243 groupes totalisant 3408 sérums.
RT-PCR pour la détection de l’ARN du HVE virus
La réalisation de tests de RT-PCR (Reverse transcriptase-polymerase chain reaction) en temps réel spécifique à cette pathologie a été faite sur des échantillons de foies et de rates prélevés sur les cas suspects de tous les élevages étudiés. Un kit commercial a été utilisé à ce propos (Kylt Avian Hepatitis E (aHEV), Anicon Labor GmbH, Hoeltinghausen, RFA) en utilisant les procédures décrites par le fabricant. La lecture à été réalisée au moyen d’un thermocycleur Applied Biosystem 7500 Fast (Thermo Fisher, USA).
RÉSULTATS
Paramètres épidémiologiques, signes cliniques et lésions macroscopiques
Le tableau 2 représente les caractéristiques des élevages concernés et les principaux signes cliniques présentés par les oiseaux. L’étude a concerné un total de 14 élevages dont 11 de pondeuses œufs de consommation et 3 de reproducteurs type chair âgés de 35 à 76 semaines provenant des principales régions de production avicole. Les animaux issus de tous les cas décrits ont présenté une crête pâle et une chute de ponte. Généralement les poules pondeuses montraient une crête pâle bien visible et leur abdomen contenait un liquide rouge visible avant l’ouverture.

La chute de ponte combinée à l’augmentation du taux de mortalité passant de 0.12 à plus de 0.2% par semaine était des éléments également constants et renforçaient davantage la suspicion. Il est à noter que la chute de ponte n’a pas été associée à une dégradation de la qualité de l’œuf. D’autres signes cliniques et/ou lésions ont été parallèlement observées de manière variable d’un élevage à un autre. Les figures 1 et 2 représentent les courbes de production de l’élevage N°1 renfermant deux bâtiments de même âge avec une chute de ponte de 18 % avec une allure contagieuse touchant un premier bâtiment à 60 semaines d’âge ensuite le second à 61 semaines d’âge.


Les lésions macroscopiques les plus constamment trouvées chez les oiseaux suspectés atteints d’hépatite E consistaient en une pâleur des crêtes et de la carcasse, de l’hypertrophie et décoloration du foie, des ruptures et des hémorragies du foie associé ou non à de la splénomégalie. Une régression de la grappe ovarienne a été observée sur quelques cas. Les poules présentant des ruptures et hémorragies du foie (Photos 1-4) n’étaient pas forcément grasses et ne présentaient pas de dépôt de graisse en bas de leur abdomen. La régression des ovaires et de l’oviducte était bien évidente sur les poules provenant d’élevage ayant fait une chute de ponte. Les rates étaient hypertrophiées et dans certains cas, elles présentaient des zones de décoloration plus moins étendues dans le parenchyme splénique (photos 5-6).



La répartition des différentes lésions macroscopiques hépatiques est représentée sur le tableau 3. Neuf cas-élevages (64%) dont les animaux ont présenté des ruptures et hémorragies hépatiques (cas-Hg/R) avec des foies décolorés et recouverts de gros caillots de sang. Ils étaient tous des élevages de poules pondeuses (œufs de consommation) et étaient âgés de 44 à 76 semaines. Les 5 autres cas (36%) ayant montré de l’hypertrophie et un aspect dégénéré des foies (Hy-F), étaient des élevages de poules reproductrices (type-chair) dans 80% des cas et 1 seul cas de poules pondeuses âgées de 35-64 semaines (Tableau 3).

Lésions microscopiques
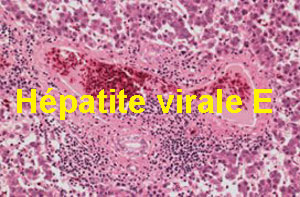
Les lésions microscopiques les plus spectaculaires et les plus constantes étaient localisées au niveau des foies (Tableau 3). Elles consistaient en une vasodilatation et des hémorragies étendues sous-capsulaires et intra-parenchymateuses qui étaient présentes parmi les oiseaux de 100% des cas-HG/R et 80% des cas-Hy-F (Microphotos 1 & 2).

Une hépatite interstitielle discrète à marquée était également constamment observée chez les animaux des cas-Hg/R (100% des cas) alors qu’elle n’était présente que chez 60% des cas Hy-F (Microphotos 3 à 6).


Ces hépatites consistaient en une infiltration discrète à sévère des espaces portes par une population de cellules inflammatoires de lymphocytes, macrophages et des polynucléaires hétérophiles. Elles étaient associées à de la présence de foyers plus ou moins étendues de nécrose hépatique dans 56% de cas Hg/R et 40% de cas Hy-F (Microphotos 7 à 10).


Parallèlement, les foies issus des animaux examinés présentaient de la stéatose hépatique (Microphoto 10) discrète à accentuée à des fréquences variables selon le groupe d’animaux (100% chez les animaux Hy-F et 78% chez les cas-Hg/R). Aussi, la présence variable, discrète à modérée sur des foies des animaux examinés de plaques amorphes hyalines évoquant des dépôts de substance amyloïde ou de fibrine (Microphoto 11). Elles étaient détectées respectivement dans 67% et 40% des cas-Hg/R et Hy-F. Ces plaques étaient dans leur majorité positive à la coloration au Rouge Congo (Microphoto 12). Des colonies bactériennes ont été également observées sur les foies de 21% du total des cas au total 14 cas référés ont fait l’objet d’investigations pathologiques microscopiques.

Les lésions spléniques associées consistaient essentiellement en de l’hyperémie et la dégénérescence/nécrose des follicules lymphoïdes chez les animaux issus de 56% des cas-Hg/R et 40% des cas Hy-F. La présence de colonies bactériennes a été relevée sur les rates de 36% du total des cas. De l’hyperplasie des follicules hépatiques a été notée sur un seul cas (7% du total des cas) issu du lot des cas Hg/R. Des plaques amorphes hyalines ont été également notées sur les coupes de rate avec nécrose et étaient positive à la coloration au Rouge Congo (Microphoto 13 et 14).

Recherche des anticorps anti-HEV
Aucun des sérums testés pour la recherche par ELISA-HEV des anticorps anti-HEV n’a été trouvé positif. De même que les sérums de 2018-2020 issus d’élevages non-suspectés atteints d’HEV, n’ont montré aucune positivité au test ELISA-HEV
RT-PCR des échantillons du foie te de la rate
Les tests de la RT-PCR n’ont pas permis de mettre en évidence la présence de l’ARN viral HEV dans les échantillons de foies et de rates prélevés d’animaux suspects atteints d’HEV.
DISCUSSION
La suspicion de l’HVE basée sur l’évolution cliniques et les changements des paramètres de production, la mortalité et les lésions macroscopiques a été réconfortée par les trouvailles des investigations histopathologiques. Les lésions microscopiques décrites pour les cas étudiés ont été essentiellement caractérisées (majorité des cas) en tant qu’hépatites interstitielles associées à des hémorragies extensives et qui dans plus de 50% des cas présentaient aussi de la nécrose hépatique de coagulation. En plus, dans 40 à 67% des cas des plaques amorphes hyalines assimilables à de la substance amyloïde après coloration au rouge Congo y ont été notées. Ces changements microscopiques sont similaires à ceux décrits dans le cas l’HVE et sont par conséquents compatibles avec le diagnostic de cette dernière si l’on considère également le tableau clinique et lésionnel macroscopique. En effet, l’HVE ou syndrome de l’hépatite splénomégalie (SHS) affecte les poules pondeuses et les poules reproductrices type chair, et se manifeste par de la mortalité, une diminution de la production d’œufs. Les oiseaux atteints présentent une hépatomégalie et splénomégalie, avec une hépatite marquée, une vasculite, hémorragies, nécrose de coagulation et dépôt de substance amyloïde dans les deux organes (Shivaprasad 2003; Morrow et al., 2008; Agunos et al., 2006; Priscilla et al., 2013).
Cependant, sur 50% du total des cas, en plus des changements d’hépatite décrits ci-dessus, la présence de stéatose hépatique modérée à sévère a été associée. Ce qui laisserait penser à une association du SHS et du syndrome hémorragique du foie gras (Fatty liver and hemorragic syndrome: FLHS). Des cas d’une telle association (SHS+FLHS) ont été rapporté par Agunos et al., (2006) au Canada chez des troupeaux de poules pondeuses nourris à base d’une ration contenant 11% de lipides totaux en vue de la production d’œufs enrichis en acides gras Oméga-3 et chez qui le virus de l’hépatite viral E a été mis en évidence par RT-PCR.
Sur un seul cas, seule la stéatose a été notée sans présence d’hépatite. Le syndrome hémorragique du foie gras (FLHS) est une maladie sporadique avec une certaine similitude avec le SHS et survient principalement chez les poules pondeuses élevées en cage et alimentées à base d’une ration riche en énergie, ce qui entraîne une augmentation de l’accumulation de lipides dans le foie (Crespo et Shivaprasad, 2003). La pathogénie de FLHS n’est pas encore très bien connue. Cependant, l’hypertrophie associée à l’accumulation excessive de lipides dans le tissu hépatique (stéatose) serait responsable de la rupture du réseau hépatique de réticuline et de la capsule et puis des hémorragies (Hansen et Walzem, 1993).
Ces deux syndromes (SHS et FLHS) peuvent être différenciés par un examen histologique, car les hépatocytes des foies de SHS ne contiennent pas un excès de lipides et les foies de FLHS ne présentent pas de nécrose massive (Agunos et al., 2006), comme c’est le cas d’une grande partie des cas de la présente étude.
La coloration positive au Rouge Congo des plaques hyalines amorphes notées sur les foies et rates de poules examinées aurait été un élément décisif dans la confirmation des plaques amyloïdes et par conséquents de l’atteinte par l’Hépatite E des cas investigués. Néanmoins, il a été signalé que cette coloration n’est pas exclusivement spécifique à la substance amyloïde et pourrait colorer aussi d’autres types de protéines notamment l’élastine et la fibrine (Gilbertson et Hunt, 2013). En vue de la confirmation des plaques amyloïdes, l’examen immuno-histochimique utilisant des anticorps anti-amyloïde sur coupes suspectes (Gilbertson et Hunt, 2013) peuvent été utilisés pour renforcer le diagnostic pathologique de l’HVE.
Sur les cas étudiés, les investigations sérologiques et moléculaires étaient négatives et n’ont pas permis de confirmer la suspicion pourtant fondée de l’Hépatite virale E sur la base des lésions macroscopiques et microscopiques et les éléments épidémiologiques et cliniques. De même, les résultats sérologiques négatifs de l’étude séro-épidémiologique n’écartent pas la possibilité de la circulation du virus. Le seul test ELISA actuellement commercialisé est basé sur des antigènes testés par un seul génotype de VHE aviaire. En raison de l’hétérogénéité génétique des isolats du VHE aviaire de différentes régions géographiques, la spécificité et la cohérence de ces tests est variable en fonction des génotypes du VHE aviaire ce qui pourrait être une limitation pour la détection de tous les autres génotypes de VHE aviaire (Zhao et al., 2013). Les publications rapportant l’utilisation de ce même kit BLS ne sont pas nombreuses et se limitent probablement au travail de Matczuk qui rapporte la circulation du virus HVE en Pologne et qu’elle a génétiquement classé dans le génotype 2 (Matczuk et al., 2018).
Pour détecter efficacement l’infection par le VHE à partir de différentes sources, l’ELISA devrait être adapté pour l’identification des épitopes du VHE aviaire spécifique à la région (Sun et al, 2019). Ceci pourrait expliquer en partie la négativité au HEV des sérums des animaux affectés de la présente étude considérant que le génotype du dit virus au niveau national serait éventuellement différent à celui du kit ELISA utilisé, ce dernier ne mentionnant pas la filiation génétique de l’antigène ayant servi pour l’imprégnation des kits utilisés d’autant plus qu’actuellement cinq génotypes différents sont identifiés avec une répartition géographique régionale marquée; en l’occurrence le génotype 1 en Australie et en Corée, le génotype 2 aux USA et en Corée, le génotype 3 en Europe, le génotype 4 en Hongrie et en Taiwan et puis finalement le génotype 5 récemment décrit en chine causant des ruptures hémorragiques du foie mais totalement séparé des 4 autres gènes sur le plan phylogénique (Sun et al., 2019, Su et al., 2018).
Effectivement, sur le plan épidémiologique régional, des preuves de la circulation du virus dans les élevages espagnols avaient été mises en évidence dès 2009 (Peralta et al., 2009) et au regard de la proximité géographique et des échanges commerciaux intenses avec le Maroc, les risques de contagion ne sont pas à écarter. Il faut cependant noter que l’enquête séro-épidémiologique de Peralta était basée sur l’utilisation d’un kit Elisa préparé in situ et reproduisant la technique précédemment décrite par Hasqshenas et al. (2002) impliquant l’utilisation d’un antigène HVE recombinant exprimé sur E. coli. De même, les amorces pour la RT-PCR étaient reproduites selon la technique de Sun et al., (2004); le séquençage a abouti à la classification de la souche espagnole dans le génotype 2 mais dans un cluster isolé.
Dans la présente étude, le diagnostic différentiel quant à la chute de ponte a été aussi réalisé (pour une partie des élevages) par l’étude de la cinétique des anticorps vis-à-vis de la maladie de Newcastle, la bronchite infectieuse, l’influenza aviaire faiblement pathogène H9N2, l’encéphalomyélite aviaire, la grosse tête et l’anémie infectieuse. Aucune séroconversion notable n’a été relevée qui puisse être liée à la chute de ponte ni à travers la variation moyenne des titres Elisa ni à travers le coefficient de variation (Résultats non montrés ici).
Aussi, la négativité de la recherche du virus par RT-PCR pourrait-elle s’expliquée par le fait que cette recherche a été effectuée sur des prélèvements de foie et de la rate. Il a été bien documenté qu’il est très difficile d’identifier le virus à partir uniquement de tels échantillons et que les échantillons de choix sont constitués par le liquide biliaire et les fientes (Pricillia et al, 2013, Peralta et al., 2009). D’autre part, vu la variabilité génomique des virus à ARN et plus particulièrement celle du HEV par sa diversité antigénique, plusieurs travaux insistent sur la nécessité du choix approprié des amorces et les risques des résultats faussement négatifs rencontrés lors d’examens à partir d’échantillons cliniques (Troxler et al., 2011; Hoffmann et al., 2009).
CONCLUSION
Les résultats préliminaires sont mitigés mais pointent davantage sur la nécessité d’élargir le champ d’investigation en développant les outils de diagnostic sérologiques et moléculaires plus spécifiques au contexte épidémiologique. Cette étude rapporte les premières descriptions de la pathologie au Maroc.
RÉFERENCES
Agunos A.C., Yoo D., Youssef S.A., Ran D., Binnington B., Hunter D.B. (2006). Avian hepatitis E virus in an outbreak of hepatitis–splenomegaly syndrome and fatty liver haemorrhage syndrome in two flaxseed-fed layer flocks in Ontario. Avian Pathol., 35: 404-412.
Crespo R., Shivaprasad H.L. (2003). Developmental, metabolic and other noninfectious disorders. In Y.M. Saif, H.J. Barnes, J.R. Glisson, A.M. Fadly, L.R. McDougald, D.E. Swayne (Eds.), Diseases of Poultry, 11th ed. (pp. 1048-1102). Ames: Iowa State University Press.
Emerson S.U., Purcell, R.H. (2003). Hepatitis E virus. Rev. Med. Virol., 13: 145 -154.
Gilbertson J.A., Hunt T. (2013). Amyloid. In: Bancroft’s Theory and Practice of Histological Techniques (7th Ed.). Suvarna S.K., Layton C., Bancroft J.D. (Eds), Elsevier Ltd, pp. 271-290.
Hansen R.J., Walzem R.L. (1993). Avian fatty liver hemorrhagic syndrome: a comparative review. Adv. Vet. Sci. Comp. Med., 37: 451- 468.
Haqshenas G., Huang F., Fenaux M., Guenette D., Pierson F., Larsen C. (2002). The putative capsid protein of the newly identified avian hepatitis E virus shares antigenic epitopes with that of swine and human hepatitis E viruses and chicken big liver and spleen disease virus. J. Gen. Virol., 83: 2201–2209.
Hoffman B., Beer M., Reid S.M., Mertens P., Oura, C. A.L., Rijn P.A.V., Slomka M.J., Bank J., Brown I. H., Alexander D.J., King D. (2009). A review of RT-PCR technologies used in veterinary virology and disease control: sensitive and specific diagnosis of five livestock diseases notifiable to the World Organisation for Animal Health. Vet. Microbiol., 20: 1-23.
Huang F.F., Sun Z.F., Emerson S.U., Purcell R.H., Shivaprasad H.L., Pierson F.W., Toth T.E., Meng X.J. (2004). Determination and analysis of the complete genomic sequence of avian hepatitis E virus (avian HEV) and attempts to infect rhesus monkeys with avian HEV. Journal of General Virology, 8: 1609 -1618.
Matczuk, A.K., Cwiek K., Wieliczko A. (2018). Avian hepatitis E virus is widespread among chickens in Poland and belong to genotype 2. Arch. Virol., 164: 595-599.
Morrow C.J., Mátrai E., Klausz A., Wood A.M., Richter S., Jaskulska B. (2008). Avian hepatitis E virus infection and possible associated clinical disease in broiler breeder flocks in Hungary. Avian Pathol., 37: 527–535.
Peralta B., Biarnès M., Ordonez G., Porta R., Marga M., Mateu E., Pina S., Meng X.J. (2009). Evidence of widespread infection of avian hepatitis E virus (Avian HEV) in chickens from Spain. Vet. Microbiol., 137: 31-36.
Priscilla F.G., Trampel D.W., Opriessnig T. (2014). Identification and characterization of avian hepatitis E virus in 2013 outbreaks of hepatitis-splenomegaly syndrome in two US layer operations. Avian Pathol., 43: 357-363.
Ritchie S. J., Riddell C. (1991). British Columbia.“Hepatitis-splenomegaly” syndrome in commercial egg laying hens. Can. Vet. J., 32: 500–501.
Shivaprasad, H.L. (2003). Hepatitis-splenomegaly syndrome. In Y.M. Saif, H.J. Barnes, J.R. Glisson, A.M. Fadly, L.R. McDougald & D.E. Swayne (Eds.), Diseases of Poultry, 11th edn., Ames: Iowa State University Press. pp. 1186 -1188.
Su Q., Li Y., Meng F., Cui Z., Chang S., Zhao P. (2018). Hepatic rupture hemorrhage syndrome in chickens caused by a novel genotype avian hepatitis E virus. Vet. Microbiol., 222: 91-97.
Sun P., Lin S., He S., Zhou E-M., Zhao Q. (2019). Avian Hepatitis E Virus: With the Trend of Genotypes and Host Expansion. Front. Microbiol., 10: 1696.
Troxler S., Marek A., Prokofieva I., Bilic I., Hess M. (2011). TaqMan real-time reverse transcription-PCR assay fur universal detection and quantification of avian hepatitis E virus from clinical samples in the presence of a heterologous internal control RNA. J. Clin. Microbiol., 49: 1339-1346.
Zhao Q., Sun Y.-N., Hu S.-B., Wang X.-J., Xiao Y.-H., Hsu W. H. (2013). Characterization of antigenic domains and epitopes in the ORF3 protein of a Chinese isolate of avian hepatitis E virus. Vet. Microbiol., 167: 242–249.
Publié-e
Comment citer
Numéro
Rubrique
Licence
© Revue Marocaine des Sciences Agronomiques et Vétérinaires
