Détection de campylobacter spp thermophile associé à l’hépatite vibrionique/ foie marbré dans un élevage de poulet fermier
Résumé
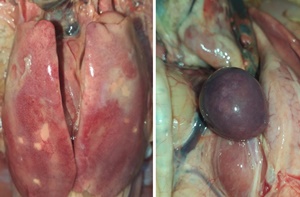
Durant le mois de Juillet 2020, 5 poulets fermiers âgés de 44 jours (cas 2) et 2 autres âgés de 71 jours (cas1) provenant de deux bâtiments différents du même élevage ont été référés pour cause de diarrhées et une augmentation du nombre des mortalités. A l’autopsie, une péricardite, une périhépatite fibrineuses, une entérite, des ulcères au niveau du gésier, et de multiples foyers de nécrose (1mm~) au niveau du foie associés à une hépatomégalie, et une splénomégalie avec congestion de la rate ont été relevées. Un sujet du cas 2 a présenté nombreux petits foyers jaunâtres (granulomes) de 1-2 mm de diamètre. Des calques de foie et de la bile ont été réalisés sur des cartes FTA pour une PCR en temps réel, ensuite des prélèvements du cœur, du foie, la rate et la moelle osseuse du fémur ont été prélevés stérilement pour la bactériologie. Des sections du foie, de la rate, et des reins ont été mis dans une solution de formol 10 % phosphaté pour l’histopathologie. Des colonies d’Escherichia coli non-typable ont été présentes chez les sujets du cas 2. L’histopathologie a révélé une hépatite nécrosante, une déplétion lymphoïde sévère au niveau de la rate, et des colonies bactériennes basophiles denses ont été relevées au niveau du foie et de la rate du sujet avec les granulomes, les vaisseaux sanguins des organes prélevés étaient remplis d’amas de fibrine et de thrombocytes. La PCR a révélé la présence de campylobacter spp thermophile.
Mots clés: Campylobacter spp, hépatite vibrionique, Spotty liver disease, poulet fermier
Téléchargements
Introduction
Campylobacter spp appartient à la famille des campylobacteriaceae superfamille VI. Une bactérie gram négatif, non sporulée, ayant une morphologie incurvée (en S) se transformant en forme de cocci face à des conditions délétères comme un milieu riche en oxygène (Alexander et al., 2003; Skirrow, 1994; Skirrow, 2006). Elles sont connues par leurs exigences de croissance particulièrement fastidieuses, une durée d’incubation assez longue (de 3 à 7 jours) dans une ambiance microaérophilique. Campylobacterspp a été décrit pour la première fois en 1886 par Theodor Escherich à partir du colon des enfants atteints de cholera infantile (Van et al., 2016). En 1905 Mcfadyean a décrit la même bactérie durant ses investigations concernant des épizooties d’avortements infectieux chez un troupeau de brebis en Angleterre (Macfadyean et Stockman, 1913 cité par Skirrow, 2006). En 1919, Smith et Taylor ont isolé la bactérie pour la première fois chez des troupeaux de bovins manifestant des avortements aux Etats Unis(Smith and Taylor, 1919) ; Ils ont nommé l’agent isolé vibrio fetus. Sebald et Veron ont remarqué que cette bactérie microaérophilique constitue un genre distinct des « vibrios », et ils l’ont renommé campylobacter fetus en 1963 (Sebald and Veron, 1963; Véron and Chatelain, 1973). L’infection à campylobacter fetus chez l’Homme reste rare Campylobacter fetus (Skirrow, 2006). Cependant, les campylobacters associés à la gastro-entérite aigue chez l’Homme appartiennent à un groupe distinct désigné « thermophile » qui fait allusion à leur température optimale de croissance (42°C- 43°C) comparativement aux autres campylobacters. Ce groupe représente un véritable risque pour la santé publique dépassant les salmonelles (Asmai et al., 2019). Les quatre espèces les plus redoutables sont C.jejuni et C.coli et à moindre degré C.lari et C.upsaliensis, appelées aussi couramment «la bactérie de la volaille». De plus l’infection à campylobacter chez l’Homme est à l’origine du syndrome Guillain-Barré, une maladie auto-immune post infectieuse (Swayne et al., 2013). Les espèces aviaires notamment la volaille domestique sont considérées comme des porteurs asymptomatiques du pathogène, le portage est généralement intestinal avec ou sans manifestations cliniques (Alexander et al., 2003; Jennings et al., 2011; Skirrow, 1994)Swayne et al., 2013). Peu d’importance a été accordée à l’étude de la pathogénicité de la bactérie chez le poulet jusqu’aux années 1950s, une hépatite nécrosante fut attribuée à campylobacter jejuni et a été rapportée dans plusieurs pays(Peckham, 1958), la pathologie fut appelée l’hépatite vibrionique. Les rapports de la maladie ont disparu vers les années 1970s. Depuis les années 2000, plusieurs auteurs ont décrit la ré-emergence de la maladie (Crawshaw and Young, 2003) connue actuellement sous le nom spotty liver disease SLD (foie marbré). Nous rapportons dans cet article une hépatite nécrosante et des granulomes au niveau du foie, avec cliniquement une diarrhée dans un élevage de poulet fermier au Maroc, associés aux campylobacters thermophiles. Le cas présent tire son importance de deux facteurs :1°/ La bactérie mise en évidence a des répercussions sur la santé publique et 2°/ ce type d’élevage constitue actuellement une tendance lourde comme niche pour les investisseurs.
Matériel et méthodes
Historique du cas
Les poulets examinés proviennent d’un élevage multi-âge, semi-extensif de poulet fermier. La sortie sur le parcours extérieur durant la journée commence vers l’âge de 3 semaines. Le site comprend plusieurs petits bâtiments insérés dans une rotation avec une mise en place chaque semaine de sorte qu’il n’y a jamais de vide sanitaire complet de la ferme. Les bâtiments affectés comprenaient environ 1300 sujets chacun. Depuis Juillet 2020 le bâtiment du cas 2 (âge de 71 jours) a enregistré des diarrhées et une élévation du nombre des mortalités (8 sujets par jour pendant 4 jours) et le bâtiment du cas 1 (âge de 44 jours) a enregistré les mortalités suivantes: 2-6-5-11 sujet/ jour.
Analyse microbiologique
Des échantillons de foie, de la rate, du cœur, de la grappe ovarienne, et de la moelle osseuse du fémur provenant de 3 sujets du cas 2, et de 2 sujets du cas 1 ont été prélevés de manière stérile, et acheminés ensuite à l’unité de bactériologie. Une recherche d’Escherichia coli pathogène et de salmonella a été réalisée en utilisant le milieu EMB (Eosin Methylene Blue), XLD (Xylose lysine Désoxycholate), et le vert brillant suivant les normes marocaines en vigueur NM 08.0.133 et NM 08.0.550pour E.coli et salmonella respectivement. Les prélèvements ont été aussi étalés sur les milieux TSA (TryptaseSoy agar), la gélose au sang, et le milieu Chapman (Oxoid, France) pour la recherche des pasteurelles et des staphylocoques respectivement.
Examen histopathologique
Des portions du foie, de la rate, et des reins prélevés sur 3 sujets ont été prélevés et mis dans une solution de formol 10 % neutralisé pour l’examen histopathologique. Une coloration à l’hématoxyline-Eosine (H&E) a été effectuée. Le logiciel Liteview@ a été utilisé pour ajuster la qualité des images, mais aucune modification n’a été apportée.
PCR en temps réel
Des calques du foie et de la bile ont été prélevés sur des cartes FTA (Flinders Technology Associates). L’extraction de l’ADN a été réalisée moyennant un Kit KYLT®(AniCon, RFA) conformément aux directives du fabricant. L’amplification a été effectuée dans les conditions suivantes: 95°C pendant 10 min, suivi de 42 cycles de dénaturation à 95 °C pendant 15 sec, et finalement l’hybridation/extension à 60 °C pendant 1 min. La révélation est basée sur la technologie Taqman, l’ADN de campylobacter est marqué par le FAM et le contrôle interne par le HEX. Un échantillon est considéré positif lorsque le Ct (cycle de Threshold) est inférieur à 42.
Résultats
Autopsie
Les oiseaux reçus ont été désinfectés puis ouverts pour l’examen nécropsique soit un total de deux poulets du cas 2 et 5 autres du cas 1, les lésions observées sont présentées au niveau du tableau 1.
Tableau 1: Lésions macroscopiques relevées à l’autopsie.

Figure 1:

Figure 2:

Analyses microbiologiques
La recherche de salmonelles sur les foies et rates prélevés des deux casa été négative sur culture directe et après 24 H d’enrichissement. La culture bactérienne des foies du cas 2 a révélé des colonies compatibles avec E.Coli sur le milieu EMB. Le sérotypage a révélé une E.Coli non typable. Les autres cultures bactériennes utilisées pour la détection de pasteurelle et de staphylococcus ont été négatives.
Examen histopathologique
Les lésions que nous avons relevées sont présentées dans le tableau 2 et figure 3 (A, B, C, D, E, F) ci-dessous
Tableau 2: résultats de l’examen histopathologique des organes

Présence de colonies bactériennes basophiles au centre de quelques foyers de nécrose. Des foyers de nécrose des hépatocytes oblitération des veines (portes et Centro- lobulaires) par des thrombus de fibrine et des thrombocytes, quelques vaisseaux contiennent des colonies bactériennes.
Présence de multiples granulomes centrés par des masses denses basophiles (colonies bactériennes) encapsulées par une fine lame fibreuse et un anneau de nécrose hépatocytaire chez le sujet manifestant des granulomes à l’autopsie
La PCR en temps réel
La PCR en temps réel réalisée sur les calques du foie et la bile a révélé la présence de campylobacter spp thermophile avec des CT de 28,9 et 23,3 pour le cas 1 et cas 2 respectivement.
Figure 3:

Discussion
Les campylobacters thermophiles sont bien adapté au tube digestif des oiseaux, ils sont normalement présents au niveau de l’intestin des espèces aviaires domestiques, notamment le poulet, la dinde, les canards, et les oies (Jennings et al., 2011)(Swayne, et al, 2013). En outre (Skirrow, 1994) a rapporté le taux de portage le plus élevé chez la volaille comparativement aux autres espèces (primates, équidés, ruminants, et porcins). La bactérie colonise extensivement le gros intestin sans répercussion clinique ou lésionnel, dans certains cas, elle peut être associée à une légère diarrhée, et une légère chute de ponte chez la poule pondeuse(Alexander et al., 2003; Skirrow, 1994)(Swayne et al., 2013). Elle a aussi été détectée au niveau du foie et du sang des oiseaux cliniquement sains (Crawshaw, 2019; Lemos et al., 2015; Skirrow, 1994). Le germe est également résistant à la bile, son isolement est même plus aisé sur celle-ci comparativement au foie (Crawshaw, 2019).
La pathogénicité des campylobacters thermophiles chez les oiseaux n’est pas bien élucidée, notamment en raison de leur importance économique négligeable, ils tirent leur importance du risque qu’ils constituent pour la santé publique (Swayne et al., 2013). Toutefois, entre les années 1950s et 1970s, une hépatite nécrosante a été rapportée chez la volaille aux Etats Unis, au Canada, en Europe, et en Australie (Alexander et al., 2003; Crawshaw, 2019; Peckham, 1958). La maladie a été associée à un microorganisme vibrio-like, d’où son nom l’hépatite vibrionique aviaire HVA (ou avian vibrionic hepatitis AVH). L’étiologie n’a pas été établie notamment à cause de sa disparition après l’apparition des élevages en cage chez la pondeuse.(Peckham, 1958) a associé la maladie à campylobacter jejuni. A partir des années 1980s, une pathologie similaire au AVH, nommée foie marbré (ou SLD spotty liver disease) est apparue en Australie, elle a aussi été rapportée en Angleterre, et en Ecosse. Depuis, les termes AVH et SLD sont utilisés comme synonymes pour désigner une hépatite nécrosante focale à allure sporadique chez la volaille (Jennings et al., 2011). Les deux maladies se ressemblent sur le plan clinique, lésionnel, et épidémiologique. Cependant l’étiologie de l’AVH n’a pas été établie, pareillement l’étiologie du SLD est toujours discutée. Lam et al. (1992) ont effectué une infection expérimentale par C.jejuni isolés à partir des fientes de poulet et du foie de la dinde, les deux espèces ont été inoculées par leurs isolats respectivement, l’étude a conclu que le germe cause une mortalité embryonnaire chez le poulet et la dinde mais seul l’isolat de la dinde a pu reproduire la nécrose hépatique.
Parallèlement en 2011 Jennings et al. ont prouvé que C. jejuni seul ne peut pas causer la maladie chez le poulet et que sa pathogénicité dépend d’un autre facteur intrinsèque à l’hôte. En 2015, Crawshaw et al. ont identifié une nouvelle espèce de campylobacters thermophiles, appelée campylobacter hepaticus reconnue actuellement comme agent causal du foie marbré SLD chez la poule pondeuse élevée au sol. Toutefois aucun prélèvement des cas déclarés de l’AVH n’a été conservé pour pouvoir extraire le matériel génétique de l’agent causal. La différence entre les deux maladies réside dans le fait que les cas de l’AVH ont rapporté des hémorragies sous capsulaires au niveau du foie (Crawshaw, 2019). (Crawshaw et al., 2015) ont émis l’hypothèse d’une possibilité d’erreur de diagnostic puisque l’hémorragie sous capsulaire du foie est actuellement attribuée au syndrome du foie gras hémorragique ou l’hépatite E (HEV), ils ont aussi suspecté une probabilité de coïnfection chez ces oiseaux. En effet (Crespo et al., 2015) ont rapporté une forme atypique de l’hépatite E chez des poules pondeuses d’un élevage biologique. Les oiseaux ont manifesté des chutes de pontes d’environ 40 %, un taux de mortalité hebdomadaire de 1%, à l’autopsie des foyers de nécrose multifocaux similaires à ceux observées lors de l’hépatite vibrionique ont été notés. La PCR réalisée a révélé 50 % de cas positifs pour le gène de l’hélicase et 90 % pour le gène de la protéine de la capside du virus de l’hépatite E et un cas positif de campylobacterspp sur six prélèvements de foie testés (Crespo et al., 2015).
Les poulets fermiers rapportés dans le présent article ont présenté une faible morbidité caractérisée par des diarrhées, des foyers de nécrose multifocaux avec périhépatite fibrineuse, une entérite mucoide, et un cas de granulomes. Le tableau clinique et lésionnel est compatible avec ceux décrits lors de l’AVH/ SLD. En effet, La pathologie est caractérisée par des petits foyers de nécrose grisâtres de 1-2 mm de diamètre et une périhépatite fibrineuse avec occasionnellement une ascite, des points de nécrose coalescents en forme de chou-fleur ont aussi été rapportés(Burch, 2005; Crawshaw, 2019; Crawshaw and Young, 2003; Jennings et al., 2011). Une entérite légère a aussi été décrite par (Grimes and Reece, 2011). Par ailleurs, les conditions de cet élevage concordent avec le contexte épidémiologique de l’apparition de la maladie. Effectivement, celle-ci touche principalement les pondeuses élevées au sol pendant le pic de ponte, les poulets élevés en extensifs, et plus rarement les pondeuses en cage, les reproducteurs, et les poulets de chair (Grimes and Reece, 2011). En outre, l’analyse bactériologique du cas 2 a révélé la présence d’une E.coli non typable, qui pourrait être à l’origine de la septicémie et aux inflammations fibrineuses de la capsule du foie et du péricarde. En effet, l’examen histopathologique a relevé des thrombus de fibrine et de thrombocytes intravasculaires au niveau du foie, de la rate et des reins associées à des colonies bactériennes au niveau des veines portes témoignant d’une septicémie bactérienne (Abdul-Aziz et al., 2016; Fletcher, 2008).
Jennings et al. (2011) ont affirmé que le développement des lésions hépatique dépend de la charge bactérienne et du stress lié aux conditions d’élevage et aux infections ce qui entrave la réponse immunitaire cellulaire à C.jejuni, favorisant ainsi la manifestation de la maladie. Nous estimons que les poulets des deux cas étudiés ont développé des lésions sévères du fait de l’excrétion continue et de la charge bactérienne importante dans l’environnement favorisées par le non-respect du vide sanitaire associé au stress du climat. D’ailleurs en Australie, la pathologie est couramment appelée « hépatite de l’été » (Grimes and Reece, 2011). Egalement, le stress infectieux exacerbé par la présence de E.coli pourrait être l’origine de la sévérité des lésions rapportées, nous estimons aussi que la forte charge bactérienne dans l’environnement est à l’origine du développement des granulomes chez le sujet rapporté. En effet Skirrow (1994) a affirmé que l’excrétion de campylobacterspp dans les fientes de volaille peut persister jusqu’à 3 mois, ce qui explique la prédisposition des élevages au sol à la maladie, contrairement à l’élevage en cage ou les fientes sont systématiquement éliminées, d’ailleurs (Crawshaw, 2019) a lié la disparition de la AVH vers les années 1970s à l’élimination de la source d’exposition de l’environnement à savoir les élevages au sol. Effectivement, très récemment au Maroc, Asmai et al. (2020) ont isolé 75 souches de Campylobacter à partir de 105 écouvillons cloacaux de poulet de chair soit 73 % de positivité à Campylobacter spp., parmi lesquelles 42 souches se sont avérés être C. coli.
Conclusion
En conclusion, La campylobacteriose est une pathologie ré-émergente posant un véritable danger pour la santé publique non seulement pour le consommateur mais aussi pour les professionnels du secteur, en effet Lemos et al., (2015) ont proposé l’usage des atteintes hépatiques comme outil d’épidémio-surveillance des campylobacters au niveau des abattoirs avicoles. En outre le portage asymptomatique chez la volaille de basse-cour, et l’excrétion de grande quantités du pathogène pourrait constituer un véritable danger pour les élevages avicoles structurés. L’infection chez la pondeuse en pic pourrait générer des pertes économiques directes liées aux chutes de ponte et aux mortalités. La mortalité est généralement étalée sur une période de 6 à 8 semaines (mortalité hebdomadaire de 1-4%). La chute de ponte peut être aigue vers le pic de ponte (perte de 10 – 25 %) ou une chute répartie sur toute la période de production (10-15%). Les pondeuses autour du pic sont particulièrement sensibles au pathogène probablement en raison du changement hormonal et du stress lié à la production, ou suite à l’élévation du taux de fer dans le sang qui est un facteur de croissance important pour la bactérie (Crawshaw, 2019). De plus certaines espèces de campylobacters sont devenues résistantes à certains antibiotiques ce qui va entraver le contrôle de la bactérie à long terme (Asmai et al., 2020).
Références
Abdul-Aziz, T., Fletcher, O.J., Barnes, H.J., Shivaprasad, H., Swayne, D.E., 2016. Avian histopathology. American Association of Avian Pathologists.
Alexander, D., Saif, Y., Barnes, H., Glisson, J., Fadly, A., McDougald, L., Swayne, D., 2003. Diseases of poultry. Diseases of poultry 11.
Asmai, R., Karraouan, B., Es-soucratti,K., En-Nassiri,H., Bouchrif,B., Karib,H., Triqui,R., 2020.
Prevalence and antibiotic resistance of Campylobacter coli isolated from broiler farms in the Marrakech Safi region,Morocco. Veterinary World 13, 1892.
Asmai, R., Triqui,R., Karib,H., Bouchrif,B., Es-soucratti,K., En-Nassiri,H. Campylobacter spp. dans les produits alimentaires d'origine animale. Revue Marocaine des sciences Agronomiques et Vétérianaires7.
Burch, D., 2005. Avian vibrionic hepatitis in laying hens. Veterinary record 157, 528.
Crawshaw, T., 2019. A review of the novel thermophilic Campylobacter, Campylobacter hepaticus, a pathogen of poultry. Transboundary and emerging diseases 66, 1481-1492.
Crawshaw, T., Young, S., 2003. Increased mortality on a free-range layer site [5]. Veterinary Record 153.
Crawshaw, T.R., Chanter, J.I., Young, S.C., Cawthraw, S., Whatmore, A.M., Koylass, M.S., Vidal, A.B., Salguero, F.J., Irvine, R.M., 2015. Isolation of a novel thermophilic Campylobacter from cases of spotty liver disease in laying hens and experimental reproduction of infection and microscopic pathology. Veterinary microbiology 179, 315-321.
Crespo, R., Opriessnig, T., Uzal, F., Gerber, P.F., 2015. Avian hepatitis E virus infection in organic layers. Avian diseases 59, 388-393.
Fletcher, O.J., 2008. Avian histopathology.
Grimes, T., Reece, R. 2011. Spotty liver disease–an emerging disease in free range egg layers in Australia. In: Proc. 16th Western Poultry Disease Conference, Sacramento, CA, 53-56.
Jennings, J.L., Sait, L.C., Perrett, C.A., Foster, C., Williams, L.K., Humphrey, T.J., Cogan, T.A., 2011. Campylobacter jejuni is associated with, but not sufficient to cause vibrionic hepatitis in chickens. Veterinary microbiology 149, 193-199.
Lemos, A., Morais, L., da Conceição Fontes, M., Pires, I., Vieira-Pinto, M., 2015. Campylobacter spp. isolation from infected poultry livers with and without necrotic lesions. Food Control 50, 236-242.
McFadyean,J., Stockman,S., 1913.Abortion in sheep. Report of the departmental committee appointed by the board of agriculture and Fisheries to inquire into Epizootic abortion. HMSO, London, United Kingdom.
Peckham, M., 1958. Avian vibrionic hepatitis. Avian Diseases 2, 348-358.
Sebald, M., Veron, M. 1963. Teneur en bases de lADN et classification des vibrions. In: Annales de l Institut Pasteur, 897-&.
Skirrow, M., 1994. Diseases due to Campylobacter, Helicobacter and related bacteria. Journal of comparative pathology 111, 113-149.
Skirrow, M.B., 2006. John McFadyean and the centenary of the first isolation of Campylobacter species. Clinical infectious diseases 43, 1213-1217.
Smith, T., Taylor, M.S., 1919. Some morphological and biological characters of the spirilla (Vibrio fetus, n. sp.) associated with disease of the fetal membranes in cattle. The Journal of experimental medicine 30, 299-311.
Van, T.T.H., Elshagmani, E., Gor, M.C., Scott, P.C., Moore, R.J., 2016. Campylobacter hepaticus sp. nov., isolated from chickens with spotty liver disease. International journal of systematic and evolutionary microbiology 66, 4518-4524.
Véron, M., Chatelain, R., 1973. Taxonomic study of the genus Campylobacter Sebald and Véron and designation of the neotype strain for the type species, Campylobacter fetus (Smith and Taylor) Sebald and Véron. International Journal of Systematic and Evolutionary Microbiology 23, 122-134.
Publié-e
Comment citer
Numéro
Rubrique
Licence

Revue Marocaine des Sciences Agronomiques et Vétérinaires est mis à disposition selon les termes de la licence Creative Commons Attribution - Pas d’Utilisation Commerciale - Partage dans les Mêmes Conditions 4.0 International.
Fondé(e) sur une œuvre à www.agrimaroc.org.
Les autorisations au-delà du champ de cette licence peuvent être obtenues à www.agrimaroc.org.

