Déterminants de l’état d’infection trypanosomienne chez le bétail N’dama du ranch de Mushie en RD Congo
Résumé
Une étude a été menée du 3 Août au 5 Septembre 2014 et du 6 Février au 7 Mars 2015 au secteur Izeli du ranch de Mushie en République Démocratique du Congo. L’objectif a consisté à étudier l’influence de certains déterminants susceptibles d’influer sur l’état d’infection trypanosomienne chez les bovins N’dama. L’échantillon de 324 bovins sélectionnés suivant la technique d’échantillonnage systématique a été obtenu selon la formule de Thrusfield (2005) en raison de 162 en saison sèche et autant pour la saison pluvieuse. L’étude a porté sur 4 troupeaux dont Sélection, Nganzaka, Dwe et Wulu-Wulu. Le diagnostic parasitologique réalisé par la technique de buffy coat et confirmé par les analyses de biologie moléculaire (PCR) ont permis de déterminer le taux d’infection trypanosomienne (Prévalence). Ce taux a été étudié par rapport à certains déterminants dont l’âge, la saison, l’hématocrite, le milieu d’élevage, l’état sanitaire du troupeau, la catégorie zootechnique et la conduite d’exploitation des troupeaux. La conclusion de l’étude révèle que la saison, l’hématocrite, le milieu d’élevage (site), l’état sanitaire du troupeau, la catégorie zootechnique et la conduite des troupeaux ont un effet significatif sur l’état d’infection trypanosomienne (p?0,05) contrairement à l’âge (p>0,05).
Mots clés: Nested-PCR, buffy coat, amorces, determinants, état d’infection trypanosomienne
Téléchargements
INTRODUCTION
Lorsque les animaux domestiques ou sauvages sont exposés à une agression trypanosomienne, le degré de morbidité ou de mortalité n’est pas le même pour tous les individus. La réaction varie entre une grande sensibilité et une grande résistance à l’infection. Pour ceux présentant une grande sensibilité, on parle de «trypanosensibles» (Zébu) par contre ceux résistant à l’infection sont dits «trypanotolérants» dont le bétail N’dama (Makumyaviri, 1987).
La résistance à la trypanosomose permet en effet à ces races d’être les seules à pouvoir vivre, se reproduire et produire dans les zones infestées de glossines. Ces races sont également dites ‘endémiques’ ou ‘natives’, dans la mesure où elles n’existent à l’état naturel que dans ces zones (Toure et Hoste, 1986). Ceci dit, trypanotolérance ne signifie pas trypanorésistance. Elle ne peut être considérée comme une propriété permanente et sûre que dans des conditions bien définies: pureté de la race, biotope d’origine, conditions alimentaires et sanitaires satisfaisantes (Authie et al., 1999). Ainsi, on peut dire que la trypanotolérance n’est donc pas un état réfractaire. Dans les régions infestées, il est essentiel de prévoir l’utilisation de médicaments trypanocides pour optimiser la production, y compris celle des races trypanotolérantes. En effet, la productivité décroît à mesure que le risque augmente (Toure et Hoste, 1986).
La capacité de résister à la trypanosomose par le bétail trypanotolérant peut être affectée par (Demey et al., 1983; Toure et Hoste, 1986): l’âge, l’immunité transmise par la mère, les infections antérieures (une verminose importante), le stress dus à un mauvais état général à la suite d’une infection intercurrente, une mauvaise alimentation (la pénurie de pâturages en fin de saison des pluies), à un surcroît de travail (fatigue excessive), l’état physiologique (sevrage, parturition, lactation), la sensibilité de l’animal à d’autres maladies, l’intensité du risque trypanosomien, la virulence de la souche de trypanosome en cause, les facteurs physiopathologiques, des croisements avec du bétail non trypanotolérant. Actuellement, du fait de divers facteurs (pression démographique, changement climatique, déforestation, agriculture, feux de brousse), de plus en plus, les caractéristiques génétiques de ces races ont tendance à disparaître (Magalie, 2006).
Cette étude a permis d’identifier les déterminants susceptibles d’influer sur la variation de l’état d’infection trypanosomienne des bovins N’dama soumis à une forte pression glossinienne au secteur Izeli du ranch de Mushie.
MATÉRIEL ET MÉTHODES
Milieu d’étude
Izeli qui est l’un de quatre secteurs du ranch de Mushie se trouve à la longitude 16°55’20’’Est, à la latitude 3°01’02’’Sud et à une altitude de 307 m. Il est délimité au Nord et à l’Est par la rivière Leboma, au Sud par la rivière Mfimi et à l’Ouest par le secteur Ndana. Il a une superficie de 32.015 ha. Le climat est du type tropical humide Aw₄. (Goubau, 2009). La texture du sol est sablonneuse en savane et argileux le long des cours d’eau. La végétation est du type Hyparrhenia rufa, Imperata cylindrica et du Panicum. Le secteur compte au total 7.339 bovins (Société des Grands Elevages N’dama en Afrique Centrale, 2015).
Animaux
L’étude a concerné les bovins de race N’Dama élevés dans un système de ranching. L’abreuvement de bêtes se fait le long de rivières qui longent les pâturages lesquels constituent l’essentiel de l’alimentation du bétail. Les sels minéraux sont apportés en complément sous forme de blocs à lécher.
Méthodes
L’étude a été transversale et descriptive et elle s’est déroulée en saison sèche du 3 août au 5 septembre 2014 et en saison des pluies du 6 février au 7 mars 2015. La taille de l’échantillon déterminée par la formule de Thrusfield (2005) a été de 162 bovins pour chaque saison. La population d’études a été de 1.101 bovins en saison sèche contre 793 en saison des pluies. Quatre troupeaux ont été choisis dont: (1) Sélection constitué de vaches de reproduction, (2) Dwe constitué de vaches de réforme et génisses de boucherie présumées malades, (3) Wulu-Wulu formé de vaches de réforme et génisses de boucherie et (4) Nganzaka avec de génisses au taureau.
L’objectif de l’étude a consisté à étudier l’influence de certains déterminants (l’âge, la saison, le taux de l’hématocrite (HCT), le milieu d’élevage, l’état sanitaire du troupeau, la catégorie zootechnique et la conduite d’exploitation) susceptibles d’influer sur la variation de l’état d’infection trypanosomienne chez les bovins de race N’Dama (Demey et al., 1983; Toure et Hoste, 1986). Ces déterminants ont servi de mesure pour apprécier leur influence sur le taux d’infection trypanosomienne (Camus, 1983; Diall et al., 1994; Organisation Internationale des Epizooties, 2005). Dans cette étude, le bovin a été considéré en état d’anémie lorsque l’hématocrite (HCT) était ≤ à 27 % (Tanenbe et al., 2010; Tasew et al., 2012).
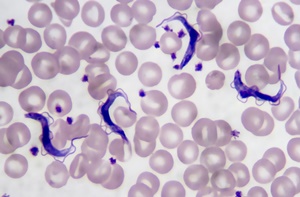
Pour la détermination du taux de l’hématocrite, le protocole suivi est celui décrit par Camus (1983); Organisation Internationale des Epizooties (2005) et Tanenbe et al. (2010). La mesure de l’hématocrite a été effectuée à l’aide d’un lecteur à hématocrite de marque Hawksley (Camus, 1983; D’Ieteren et al., 1998; Organisation Internationale des Epizooties, 2005; Tanenbe et al., 2010). Le taux d’infection trypanosomienne a été déterminée d’abord par le diagnostic parasitaire exécuté par la technique de buffy coat lequel a consisté à rechercher au microscope des trypanosomes se trouvant dans l’interface globules blancs/plasma obtenu après centrifugation (Murray et al., 1977; Camus, 1983; Organisation Internationale des Epizooties, 2005; Tanenbe et al., 2010) sur les 324 échantillons de sang prélevés sur les bovins.
Ensuite, les mêmes échantillons ont été soumis au diagnostic de la biologie moléculaire dont le Nested PCR (Desquesmes et al., 2001; Geysen et al., 2003) dont le principe consiste à amplifier sélectivement une séquence d’ADN parasitaire grâce à l’action d’une enzyme «taq polymérase» et d’amorces spécifiques (Benkirane, 1994; Duvallet, 1994; Chartier et al., 2000; Cox et al., 2005; Magalie, 2006; Acapovi et al., 2009; Tanenbe et al., 2010; Tshilenge et al., 2015).
Analyse statistique et considérations éthiques
Le logiciel SPSS 21 a été utilisé pour le test d’ANOVA en vue de la détermination de moyennes de l’hématocrite pour chaque troupeau. Le logiciel Epi Info™ version 7.2.0.1. a servi pour ressortir l’effet significatif ou non entre les différents déterminants et l’état d’infection trypanosomienne. Le seuil de confiance a été considéré à 95 %, la marge d’erreur à 5 % et p<0,05 comme significatif. Le % a servi pour déterminer le taux d’infection trypanosomienne. Enfin, l’aspect éthique a guidé le travail.
RÉSULTATS ET DISCUSSION
Les données en rapport avec l’influence de certains déterminants sur la variation de l’état d’infection trypanosomienne (EIT) ont révélé les observations selon lesquelles:
En comparant les données du tableau 1, il s’est révélé que le taux de l’état d’infection trypanosomienne chez les bovins d’âge moyen de 42 mois (6,7 %) a été > à ceux de 90 mois (4,7 %). Il en était de même pour les bovins de 84 mois (20 %) par rapport à ceux de 108 mois (8,8 %). Il est apparu que les animaux moins âgés ont présenté un taux de positivité trypanosomienne plus élevé par rapport aux plus âgés. Par contre, les mêmes données ont montré que les bovins de 90 mois d’âge (4,69 %) ont présenté un taux de positivité < à ceux de 108 mois (8,8 %). Il s’est dégagé l’observation selon laquelle les bovins moins âgés ont présenté un taux de positivité trypanosomienne plus faible que les plus âgés.
Sur base des données en présence, la statistique a révélé une différence non significative (p>0,05) entre l’âge et l’état d’infection trypanosomienne. Cette observation a été corroborée par Rowlands et al., (1990); Van den Bosshe (2001); Van de Bosshe (2002) et Ohaeri (2010).
Les données en rapport avec le tableau 2 ont montré que le nombre d’animaux positifs était passé de 12 (38,7 %) en saison sèche à 19 (61,3 %) en saison pluvieuse. Il est apparu une augmentation du taux d’infection trypanosomienne de l’ordre de + 58,4 % en saison de pluie par rapport à la saison sèche. Cette augmentation de l’infection trypanosomienne observée pendant la saison pluvieuse serait due à l’augmentation de contact entre les bovins et les glossines qui prolifèrent à la repousse de la végétation non seulement le long des cours d’eau où les bovins s’abreuvent mais aussi sur les parcours naturels caractérisés par une végétation luxuriante. Aussi, le harcèlement du bétail par les piqûres des glossines, en grand nombre pendant la saison pluvieuse, serait à l’origine du stress des animaux et cela influerait négativement sur l’état sanitaire de ceux-ci (Ogunsanmi et al., 2000; Van den Bossche, 2002). La statistique a révélé une différence significative (p˂0,05) entre la saison et l’état d’infection trypanosomienne.
La comparaison du taux de positivité de 61,3 % obtenu lors de cette étude en saison de pluie montre que cette donnée est presque similaire au 63,7 % obtenu par Cherenet et al. (2004), 59,3 % par Waiswa et Katunguka (2004) et 61,4 % par Yehunie et al., (2012).
Le tableau 3 a montré que le taux d’infection trypanosomienne a été plus élevé chez les bovins avec un HCT ≤ 27 et faible pour ceux avec un HCT ≥ 28. La corrélation entre les valeurs de l’HCT et la positivité de l’état d’infection trypanosomienne montre une différence significative (p˂0,05) entre les bovins à HCT ≤ à 27 % (27 soit 21,77 % d’infectés) et ceux à HCT ≥ à 28 % (4 soit 2 % d’infectés). Les bovins avec des valeurs HCT ≤ à 27 étaient plus infestés de la trypanosomose que ceux avec des valeurs ≥ à 28. Selon Tshilenge et al., (2015), la valeur de l’HCT est un indicateur pouvant servir de critère unique pour apprécier la résistance des animaux à la trypanosomose. Le HCT dans les zones infestées par les glossines est classiquement considéré comme un signe indicateur de la trypanosomose.
Il est apparu que le niveau de l’HCT est un élément très important pouvant influer sur l’état d’infection trypanosomienne du bétail. Plus la valeur de la HCT est élevée, plus la positivité est faible. Par contre, plus basse est la valeur de l’HCT, plus la positivité est élevée (p˂0,05). Cette affirmation est soulignée par Van den Bossche (2001); Van den Bossche et al., (2001); Castley (2002), Cherenet et al., (2004) et Tshilenge et al., (2015).
Les données du tableau 4 ont fait apparaître des variations de taux d’infection trypanosomienne (p˂0,05) par rapport aux différents milieux d’élevage (sites): Izeli centre (4,69 %), Nganzaka (6,67 %), Wulu-Wulu (8,8 %) et Dwe (20 %). Cette différence de taux de positivité entre les sites s’était expliquée par le fait que les facteurs externes liés aux milieux d’élevage n’ont pas été identiques. D’Ieteren et al. (1988) ont affirmé que le site pouvait influencer le taux d’infection trypanosomienne au sein du cheptel et il y a encore un large éventail de variation entre les sites soumis à différents niveaux d’exposition du risque.
Le faible taux d’infestation à Izeli Centre a été justifié par une DAP/jour nulle dans cet espace (0 glossine/piège/jour). La disparition des glossines dans ce milieu, avait trouvé sa justification dans les données de l’enquête entomologique qui ont montré qu’il y avait eu un recul des densités glossiniennes depuis quelques années jusqu’à un seuil ne permettant plus une transmission efficace des trypanosomes. Cette régression des glossines a été probablement due à la disparition progressive du petit et gros gibier, autrefois très abondant dans le milieu, à la suite des activités anthropiques. Cette explication a été aussi relayée par Gouteux et al., (1990); Cherenet et al., (2004); Cherenet (2006); Tanenbe et al., (2010).
L’augmentation du taux d’infection trypanosomienne dans les sites de Nganzaka, Dwe et Wulu-Wulu, s’expliquerait par le fait que ces différents milieux d’élevage présentent des caractéristiques très favorables pour l’augmentation du risque trypanosomien (Type de végétation: savane boisiée, Présence de glossines: +++ surtout en saison de pluie, DAP moyen par jour: 0,90 pour Nganzaka, 2,50 pour Dwe et 0,70 pour Wulu-Wulu) (Société des Grands Elevages N’Dama en Afrique Central, 2015).
Aussi, le risque trypanosomien parait très élevé au site de Dwe par le fait qu’il se trouve au confluent de deux rivières (Dwe et Mfimi) et à proximité de la ceinture de G. fuscipes et G. tabaniformis (Leak et al., 1988).
L’examen du tableau 5 a montré que 20 % des bovins cotés avec le score «Un» ont été enregistrés au troupeau Dwe autrement appelé «Hôpital»; 8,8 % des bovins ayant le score «Deux» appartiennent au troupeau Wulu-Wulu; 6,67 % des bovins avec le score «Trois» ont été du troupeau Nganzaka et 4,69 % des bovins ayant le score «Quatre» ont été tirés du troupeau Sélection. La statistique a révélé une différence significative (p˂0,05) entre l’état sanitaire du troupeau et le taux d’infection trypanosomienne.
Les données en rapport avec le tableau 5 ont révélé un taux trypanosomien assez élevé pour le score 1 (Troupeau Dwe) qui est constitué exclusivement des animaux malades. L’état d’immunodépression consécutif à la maladie et à la pression glossinienne permanente a justifié le taux trypanosomien élevé dans ce troupeau. Tanenbe et al. (2010) affirment qu’il y a une corrélation significative entre la parasitémie confirmée par le caractère anémiant des trypanosomes et la variation de l’état d’infection trypanosomienne. D’après Swai et Kaaya (2012), le mauvais état de santé est significativement associé à un taux élevé d’infection trypanosomienne.
Le taux d’infection trypanosomienne assez faible pour les scores 4 et 3 (Troupeaux Sélection et Nganzaka) se justifierait par le fait que ces troupeaux sont constitués de bêtes dont la majorité est en bonne santé. Swai et Kaaya (2012) affirment que le bon état de santé est significativement associé à un taux faible d’infection trypanosomienne.
Les données du tableau 6 ont montré que le taux d’infection trypanosomienne est plus élevé chez les vaches de réforme et génisses de boucherie (12,4 %) par rapport aux vaches de reproduction (4,7 %) et génisses aux taureaux (6,7 %).
Cet état s’expliquerait par le fait que le vieillissement, l’avortement, le mauvais état sanitaire, les multiples vêlages, les vêlages dystociques, le défaut physique acquis, les accidents et les divers traumatismes sont cités parmi les causes de réforme pour les vaches ou génisses. Elles sont susceptibles de provoquer une immunodépression chez la bête l’exposant ainsi à un risque trypanosomien élevé dans les milieux à forte pression glossinienne (Demey et al., 1983; Toure et Hoste, 1986). Ceci justifie l’augmentation du taux d’infection trypanosomienne chez ces deux catégories zootechniques (p˂0,05).
Les données du tableau 7 ont montré un taux d’infection trypanosomienne (4,69 %) «plus faible» pour le troupeau Sélection dont la conduite est «très bonne». Ce troupeau a, depuis longtemps, été considéré comme le miroir du ranch. C’est parmi ces bêtes que se fait la sélection des géniteurs et matrices destinés à la reproduction et à l’exportation. Ainsi, la conduite ou l’exploitation de ce troupeau est faite en conformité avec les normes zootechniques (Vermifugeage régulièrement fait, traitement prophylactique contre la trypanosomose, bonne alimentation, dippage régulier, suivi individuel des bovins, etc.). Ce qui explique l’état sanitaire flamboyant dont jouit le bétail de ce troupeau. Swai et Kaaya (2012) soulignent que le bon état de santé est significativement associé à un taux faible d’infection trypanosomienne.
On note aussi un taux d’infection trypanosomienne (6,7 %) «faible» dans le troupeau Nganzaka où la conduite a été jugée «bonne». L’absence de trypanosomes décelables dans les échantillons de ce troupeau, examinés au mois de février 2015, c’est-à-dire en saison pluvieuse, paraît donc contradictoire avec les caractéristiques du biotope du site qui abrite ce troupeau. Ceci a trouvé son explication par le traitement prophylactique avec la molécule de Chlorure d’Isométamidium auquel ce troupeau a été soumis à la fin du mois de janvier 2015. L’utilisation des traitements prophylactiques aux trypanocides baisse le taux d’infection trypanosomienne (Tanenbe et al., 2010; Bashir, 2011).
Le troupeau Wulu-Wulu a enregistré un taux trypanosomien (8,8 %) considéré «élevé» suite à une conduite d’exploitation jugée «assez bonne» par le fait que ce troupeau n’a pas été soumis au traitement prophylactique au trypanocide. Toure et Hoste (1986) ont affirmé que la trypanotolérance n’est donc pas un état réfractaire, et dans les régions infestées, il est essentiel de prévoir l’utilisation de médicaments trypanocides pour optimiser la production et maintenir le taux trypanosomien à un bas niveau.
Le troupeau Dwe avec une conduite considéréé «médiocre», a enregistré un taux d’infection trypanosomienne (20 %) très élevé par le fait qu’il est pratiquement laissé à l’abandon en raison de la présence de pathologies qui y sévissent. Sur base des données en présence, la statistique a révélé une différence significative (p˂0,05) entre la conduite des troupeaux et l’état d’infection trypanosomienne.
CONCLUSION
L’étude a confirmé l’existence de la trypanosomose bovine et elle a démontré également la corrélation entre l’état d’infection trypanosomienne et certains déterminants. Ainsi, il s’est révélé, d’une part, une différence significative entre l’état d’infection trypanosomienne et les déterminants tels que la saison, l’hématocrite, le milieu d’élevage, l’état sanitaire des troupeaux, les catégories zootechniques, la conduite des troupeaux et d’autre part, une différence non significative entre l’état d’infection trypanosomienne et l’âge.
RÉFÉRENCES
Acapovi-Yao G. L., Desquesnes M., Hamadou S., N’goran E. (2009). Prévalence parasitologique et sérologique des trypanosomoses chez trois races bovines en zones à glossines et présumée indemne en Côte d’Ivoire, Agronomie Africaine, 21: 205 - 213.
Authie E., Brigaud F., Bakalara N., Tetaud E., Baltz T. (1999). Trypanosomoses humaines et animales : Maladie du sommeil et Nagana, Annales de l’Institut Pasteur, 10 : 27-50.
Benkirane A., Rweyemanu M.M., Wojciechowski K.J., Cheneau Y. (1994). Apports de la biotechnologie au diagnostic des maladies animales, Edition AUPELF-UREF, Paris, pp. 7-17.
Camus E. (1983). Diagnostic de la trypanosomose bovine sur le terrain par la méthode de centrifugation hématocrite, Revue Sci. Tech. Off. In Epizootie, 2 : 751-769.
Catley A. (2002). Participatory investigations of bovine trypanosomiasis in Tana River District, Kenya International Institute for Environment and Development, London, UK, Med. Vet. Entomol., 16: 55-66.
Chartier C., Morel P.C., Itard J., Troncy P.M. (2000). Précis de parasitologie vétérinaire tropicale, Edition TEC & DOC/EM INTER, Collection Universités francophones, Paris, 770 pages.
Cherenet T., (2006). A comparative longitudinal study of bovine trypanosomiasis in tsetse-free and tsetse-infested zones of the Amhara Region, northwest Ethiopia, Vet. Parasitol., 140: 251-258.
Cherenet T., Sani R.A., Panandam J.M., Nadzr S., Speybroeck N., Van Den Bossche P. (2004). Seasonal prevalence of bovine trypanosomosis in a tsetse-infested zone and a tsetse-free zone of the Amhara, Region, north-west Ethiopia, Onderstepoort J. Vet. Res., 71: 307-312.
Cox A., Tilley A., Mcodimba F., Fyfe J., Eisler M., Hide G., Welburn S. (2005). A PCR based assay for detection and differentiation of African trypanosome species in blood. Exp Parasitol., 111: 24-29.
D’Ieteren G.D.M., Authie E., Wissocr H., Murray M. (1988). Trypanotolerance an option sustainable livestock production in areas at risk from trypanosomiasis, Revue Sci. Tech. Off. In Epizootie, 17: 154-175.
D’Ieteren G.D.M., Awuome K., Bokovi K., Chema S., Colardelle C., Coulibaly I., Defly A., Feron A., Grundler G., Handlos M., Hecker P., Itty P., Kakiese O., Leak S.G.A., Maehi J.H.H., Maloo S.H., Mawuena K., Minengu M., Morkramer G., Mukendi F., Mulatu W., Mulongo M., Nagida S.M., Nankodaba G., Ngamuna S., Ordner G., Paling R.W., Pelo M., Rarieya J.M., Schuetterle A., Sheria M., Thorpe W., Thorpe W., Tikubet G., Trail J.C.M., Yangari G. (1998). Genetic and environmental factors affecting trypanosome prevelance and parasitaemia in livestock, ILCA, Addis-Abeba, Ethiopie.
Demey F., Beliver M., Verhulst A. (1983). Notes sur les limites de trypanotolérance des bovins de race N’Dama ; Observations faites en Guinée, Tropicultura, 1 :103-104.
Desquesnes M., Mclaughlin G., Zoungrana A., Dávila A.M. (2001). Detection and identification of Trypanosoma of African livestock through a single PCR based on internal transcribed spacer 1 of rDNA, Int. J. Parasitol., 31: 610-614.
Diall O., Bajyana S., Magnus E., Kouyate B., Diallo B., Van Meirvenne N., Hamers R. (1994). Evaluation d’un test sérologique d’agglutination directe sur carte dans le diagnostic de la trypanosomose caméline à trypanosoma evansi, Revue Sci. Tech. Off. In Epizootie, 13: 793-800.
Duvaillet G., Bengaly Z., Reifenberg J.M., Argiro L. (1994). De nouveaux outils pour le diagnostic et l’épidémiologie de la trypanosomose animale africaine, Édition AUPELF-UREF. Paris, pp. 19-29.
Geysen D., Delespaux V., Geerts S. (2003). PCR–RFLP using Ssu-rDNA amplification as an easy method for species-specific diagnosis of Trypanosoma species in cattle, Veterinary Parasitology, 110: 171–180.
Goubau A. (2009). Etude des apports alimentaires et des possibilités de complémentation minérale de bovins N’Dama sur pâturages artificiels à Brachiaria sp. au ranch de Kolo (RD Congo), Gembloux Agro-bio tech, Université de Liège.
Gouteux J.P., Okamba-Osseke F., Sinda D. (1990). Relation entre densité glossinienne et trypanosomose bovine : le cas d’un élevage en ranching de bétail N’Dama (Louboulou, Congo), Revue d’Élevage et de Médecine vétérinaire des Pays Tropicaux, 43: 57-62.
Leak S.G.A., Awoume K., Colardelle C., Duffera W., Feron A., Mahamat B., Mawuena K., Minengu M., Mulongo M., Nankodaba C., Ordner G., Pelo M., Sheria M., Tikubet G., Toure M., Yangari G. (1988). Determination of tsetse challenge and its relationship with trypanosome prevalence in trypanotolerant livestock at sites of the African trypanotolerant livestock network, ILCA, Addis Abeba, Ethiopia.
Magalie L. (2006). La trypanosomose bovine africaine : Généralités et situation au Bénin, Thèse de doctorat, Ecole Nationale Vétérinaire de Lyon.
Makumyaviri A.M. (1987). Contribution à l’étude de la trypanotolérance : (i) Mise au point d’un modèle d’infection par trypanosomes métacycliques. (ii) Évaluation des paramètres cliniques, histologiques et immunologiques au cours de l’infection. Thèse D. Sc., Vrije Universiteit Brussel (VUB).
Murray M., Chifford D.J., Mc Intyre W.I.M. (1977). An improved parasitological technique for diagnosis of African Trypanosomosis, Trans. Royal. Soc. Trop. Med. Hyg., 71: 325-326.
Organisation Internationale des Epizooties (2005). Trypanosomoses transmises par les tsé-tsé, Manuel terrestre de l’OIE, (S.I.).
Ogunsanmi A. O., Ikede B. O., Akpavie S. O. (2000). Effects of management, season, vegetation zone and breed on the prevalence of bovine trypanosomiasis in southwestern Nigeria, Israel Journal of Veterinary Medicine, 55(2).
Ohaeri C.C. (2010). Prevelance of Tryanosomiasis in Ruminants in Parts of Abia State, Nigeria, Journal of Animal and Vetenary Advances, 9: 2422 - 2426.
Rowlands G.J., Mulatu W., Authie E., D’ieteren G.D.M., Fuite S.G.A., Nagda S.M., Peregrine A.S. (1990). 1. Épidémiologie de la trypanosomose bovine dans la vallée Ghibe, sud-ouest Ethiopie. 2. Facteurs associés aux variations de la prévalence de trypanosomes, l›incidence des nouvelles infections et la prévalence des infections récurrentes, ILCA.
Société des Grands Elevages N’dama En Afrique Centrale (2015). Rapport annuel.
Swai E.S., Kaaya J.E. (2012). A parasitological survey for bovine trypanosomosis in the livestock/wildlife ecozone of Northern Tanzania, Vet World, 5: 459-464.
Tanenbe C., Gambo H., Musongong A.G., Boris O., Achukwi M.D. (2010). Prévalence de la trypanosomose bovine dans les départements du FARO et Déo, et de la Vina au Cameroun: bilan de vingt années de lutte contre les glossines, Revue d’Elevage et de Médecine vétérinaire des Pays Tropicaux, 63 : 63-69.
Tasew S., Duguma R. (2012). Cattle anemia and trypanosomiasis in western Oromia State, Ethiopia, Revue Méd. Vét., 163: 581-588.
Thrusfield M. (2005). Veterinary Epidemiology, 3rd Edition, Blackwell science ltd, Oxford, UK, 233 pages.
Toure S., Hoste C.H. (1986). Bétail trypanotolérant et trypanotolérance, Bulletin des séances, Africana Periodical Literature Bibliographic Database, 32: 369-411.
Tshilenge M.G., Balowa K.L., Tshinguta L.C., Kazadi K.E., Bha Nsekene G., Ndadi N.V., Mukalakata N.T., Mpiana T.S., Madimba K.C.Y. (2015). Identification de Trypanosoma spp chez la chèvre dans la province du Bas-Congo, Congo Sciences, 3: 114-119.
Van den Bossche P. (2002). Seasonal variations in the distribution and abundance of the tsetse fly, Glossina morsitans morsitans in eastern Zambia, Med. Vet. Entomol., 16: 170-176.
Van den Bossche P. (2001). Some general aspects of the distribution and epidemiology of bovine trypanosomosis in southern Africa. Int. J. Parasitol., 31: 592-598.
Van den Bossche P., Rowlands G.J. (2001). The relationship between the parasitological prevalence of trypanosomal infections in cattle and herd average packed cell volume, Acta Trop., 78: 163-170.
Waiswa C., Katunguka R.E. (2004). Bovine trypanosomiasis in south-western Uganda: packed-cell volumes and prevalences of infection in the cattle, Ann. Trop. Med. Parasitol., 98: 21-27.
Yehunie B., Wudu T., Nuria Y., Sefinew A. (2012). Prevalence of bovine trypanosomosis in Wemberma district of West Gojjam zone, North West Ethiopia, Ethiopia. Vet. J., 16: 41-48.
Publié-e
Comment citer
Numéro
Rubrique
Licence

Revue Marocaine des Sciences Agronomiques et Vétérinaires est mis à disposition selon les termes de la licence Creative Commons Attribution - Pas d’Utilisation Commerciale - Partage dans les Mêmes Conditions 4.0 International.
Fondé(e) sur une œuvre à www.agrimaroc.org.
Les autorisations au-delà du champ de cette licence peuvent être obtenues à www.agrimaroc.org.

