Prise en charge d’une plaie appendiculaire complexe chez une jument
Résumé
Les plaies cutanées complexes constituent souvent un défi thérapeutique pour le praticien et une source d'inquiétude pour le propriétaire. Des soins relativement simples, une bonne observance des traitements et des grandes règles de prise en charge des plaies permettent d'obtenir des résultats très satisfaisants pour un coût acceptable. A travers l’exemple d’un cas concret, il est rappelé comment une plaie complexe doit être explorée avec minutie, largement drainée, nettoyée et débarrassée de tous corps étrangers lors de sa prise en charge. Son suivi passe par la mise en place de pansements adaptés et la gestion du tissu de granulation. Le traitement peut faire appel à des techniques chirurgicales simples de reconstruction comme la greffe en îlots.
Mots clés: Plaie complexe, cheval, greffe, pinch/punch graft, hypergranulation, pansement
Téléchargements
Introduction
L’utilisation sportive des chevaux et leur hébergement dans des espaces confinés en écurie sont les principales causes favorisant la survenue de blessures et notamment de plaies complexes. La prise en charge initiale de ces plaies constitue un défi pour le praticien sur le terrain et une angoisse pour le propriétaire quant au pronostic sportif. La gestion des plaies complexes est un processus long mais de bons résultats peuvent être obtenus par la mise en œuvre de thérapies assez simples.
Cet article présente un cas de plaie complexe pris en charge et suivi pendant environ un an.
Matériel et méthodes
Commémoratifs
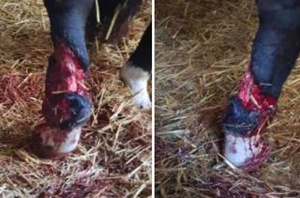
Une jument de race Selle français âgée de 4 ans a été retrouvée au box en suppression d’appui et présentant une plaie délabrante de la face dorsale du canon postérieur droit (Figure 1), depuis le tiers proximal du canon jusqu’au boulet. La plaie s’étendait médialement et latéralement laissant apparaître l’os métatarsien III et le tendon extenseur dorsal du doigt.
Les premiers éléments apportés par le soigneur ont montré que la jument s’est coincée le membre entre le mur bétonné et la porte en bois. La jument a dû se débattre pour se libérer et les lésions constatées ont été provoquées par les frottements entre l’angle du mur et la porte qui a été arrachée.
Prise en charge et suivi
Avant toute intervention, le statut vaccinal de l’animal contre le tétanos a été vérifié. Dans ce cas, le protocole de vaccination des chevaux militaires prévoit, après une primo-vaccination en deux injections à un mois d’intervalle, un rappel vaccinal annuel contre le tétanos. Le dernier rappel ayant été réalisé moins de 5 mois avant l’accident, l’administration d’un sérum antitétanique n’a pas été envisagée (Desmaizieres, 2005).
Malgré cette plaie fortement délabrante, l’animal était en mesure de se déplacer jusqu’à l’aire de douche. La plaie a été alors rincée à l’eau claire pour éliminer un maximum de sang séché, de débris de litière et d’éventuels fragments de mur ou de porte. La plaie a été douchée, sans pression, à l’eau froide, pendant une trentaine de minutes. L’objectif était de nettoyer au maximum la plaie, de réduire les saignements et d’obtenir un effet antalgique par le froid.
Une sédation a été pratiquée afin d’explorer la plaie (Détomidine à 0,04 mg/kg associée au Butorphanol à 0,1 mg/kg).
L’état initial était le suivant:
• Un volumineux lambeau de peau s’est rétracté en partie distale de la plaie;
• Le tendon extenseur dorsal du doigt est tuméfié et légèrement déchiqueté en surface sur la partie proximale de la plaie;
• L’os canon est disséqué sur la quasi-totalité de la plaie et le périoste n’était plus visible;
• Il ne semblait pas y avoir d’effraction de la capsule articulaire du boulet. Dans le cas inverse, il aurait fallu traiter le cas comme une urgence absolue (Desmaizieres, 2005);
• La radiographie initiale a montré une atteinte corticale de la partie dorsale du métatarsien principal (Figure 2).
Un traitement chirurgical de la plaie sous anesthésie générale a été décidé (Figure 3). L’animal a été placé en décubitus dorsal, le membre postérieur suspendu de manière à avoir un accès sur tout le pourtour du canon.
Un débridement des tissus non viables a été réalisé sur les marges de la plaie et autour du tendon extenseur dorsal du doigt en prenant soin de ne pas léser ce tendon. Lors de la chirurgie, l’inspection de la plaie a confirmé que l’articulation du boulet n’a pas été atteinte.
Après débridement chirurgical et rinçage abondant à l’aide de sérum physiologique, il a été décidé d’essayer de rapprocher les marges de la plaie et de remettre en place le lambeau cutané malgré les risques de nécrose et de déhiscence ultérieurs. Ce lambeau a permis en première intention de protéger les tissus profonds. La plaie était en grande partie refermée. Une ouverture a été ménagée en partie distale afin de permettre le drainage de la plaie.
Un pansement contentif de type Robert-Jones a été mis en place avant la phase de réveil.
En post-opératoire, un traitement AINS à base de flunixine méglumine (1,1 mg/Kg) pendant 2 jours, puis à base de phénylbutazone à dose décroissante (2,2 mg/Kg puis 1,1 mg/Kg après 3 jours) pendant 10 jours a été mis en place.
Une antibiothérapie (association pénicilline procaïne 33000 UI/Kg BID - gentamicine à 6,6 mg/Kg) a été instaurée pendant 10 jours. L’administration de Diurizone ND (déxaméthasone 0,25 mg/Kg - hydrochlorothiazide 25 mg/Kg) a permis de lutter contre l’œdème. Ce traitement a été renouvelé au besoin lorsque le membre est engorgé.
Dès le lendemain de l’accident, la jument s’est déplacée correctement au pas et ne présentait pas d’attitude antalgique au box.
À J3, l’extrémité proximale du lambeau recousu commençait à nécroser. Une production muco-purulente a été constatée. Le pansement absorbant contentif a été changé tous les jours après 10 min de douche et des soins locaux à base de povidone iodée diluée à 0,1%.
À J10 (Figure 4), une grande partie du lambeau cutané est nécrosée et la suture était déhiscente. On a noté une production abondante de sécrétions muco-purulentes associées à un tissu de granulation rapidement exubérant. Le lambeau cutané nécrosé a été retiré. Les soins locaux simples (irrigation de la plaie, antisepsie locale et changement quotidien du pansement absorbant) ont permis de limiter les sécrétions et d’obtenir un tissu de granulation lisse malgré l’engorgement global du membre. L’os métatarsien III était encore visible latéralement et distalement mais le recouvrement des tissus profonds se faisait rapidement.
A J15 (Figure 4), un liseré épidermique était visible sur les marges médiales de la plaie.
À ce stade, le pansement a été renouvelé toutes les 48 h. L’hypergranulation a été limitée par la mise en place de compresses imbibées de dexaméthasone directement au contact du bourgeon.
À J35, un sillon de disjonction de chaque côté de l’extenseur était visible. On a noté une production séreuse un peu plus importante. Un pansement adsorbant (Cutimed sorbact ND) et le plus stérile possible a été mis en place.
À J38 (Figure 5), il a été décidé de réaliser une greffe en îlots malgré l’œdème local. Une bande d’Esmarch a été mise en place proximalement à la plaie. Après tonte et antisepsie locale, des prélèvements de peau ont été effectués sur l’encolure à l’aide de biopsy punch de 8 mm de diamètre. Après retrait du tissu sous cutané, les greffons ont été implantés dans des «puits» réalisés dans le tissu de granulation à l’aide de biopsy punch de 6 mm de diamètre. Une hémostase a été réalisée à l’aide de cotons-tige avant l’insertion des greffons dans les puits. Au total, une vingtaine de greffons ont été mis en place. Du tulle gras a permis de recouvrir les greffons et un pansement stérile contentif a été réalisé.
Les pansements ont été renouvelés tous les jours après rinçage au sérum physiologique.
À J41 (Figure 5), on a constaté un début de contraction de la partie médiale de la plaie et du bord proximal.
À J46, on a noté l’apparition de sécrétions purulentes malodorantes. Quelques greffons ont été retrouvés dans le pansement. Un drainage abondant à base de bétadine diluée à 0,01 % a été réalisé. Des soins locaux à base de policrésulène (Lotagen ND) ont été réalisés pendant 3 jours afin de limiter le phénomène d’hypergranulation.
À J63 (Figure 6), le membre était fortement congestionné avec un tissu de granulation important recouvrant l’ensemble des greffons.
Des examens radiographiques ont permis de mettre en évidence la présence d’ostéophytes étendus sur toute la périphérie du métatarsien principal.
Un traitement à base de dexaméthasone associée à l’hydrochlorothiazide (Diurizone ND) a été mis en place pendant 12 jours à dose progressivement décroissante. L’application locale de bétaméthasone en pommade sur les bourgeons volumineux a permis également de contrôler leur développement.
Un parage chirurgical sur cheval debout a permis de faire réapparaître les greffons viables.
À J76, le liseré épidermique s’est épaissit et la plaie s’est contractée lentement. Le pansement a été renouvelé tous les 2 jours. Des soins locaux à l’eau cuivrée et au Lotagen ND ont permis de limiter la prolifération du tissu de granulation.
À J83, la plaie était propre mais le tissu de granulation a continué de se développer rapidement. Les pansements ont été changés tous les 2 jours. De la sulfadiazine argentique (Flammazine ND) a été appliquée sur toute la surface de la plaie à chaque renouvellement de pansement. Cette pommade destinée aux traitements des brûlures étendues, a permis de maintenir un environnement gras et d’assurer une antisepsie en surface de la plaie.
Un contrôle radiographique à J 100 a montré une prolifération des ostéophytes tout autour du métatarsien principal.
À J102, quelques greffons ont réapparu en partie distale de la plaie. La contraction de la plaie se faisait de manière très lente depuis les bords médial et proximal. La jument était toujours au repos strict.
Les radiographies de contrôle à J136 ont montré un suros plus lisse et mieux organisé (Figure 7).
Le tissu de granulation était lisse et rosé. La contraction de la plaie s’est poursuite. Les greffons se sont étalés progressivement de manière centrifuge. Les pansements à base de Flammazine ND ont été renouvelés toutes les 48 heures. À partir de J160, les pansements ont été renouvelés tous les 3 jours. La jument a été autorisée à marcher en main 5 minutes par jour. Le temps de marche est augmenté de 5 minutes par semaine. La jument est marchée montée à partir de 20 minutes de pas. Le travail a été alors augmenté de 5 minutes 2 fois par semaine jusqu’à 1 heure de marche.
À partir de J160 (Figure 8), le liseré épidermique s’est épaissit et la contraction de la plaie se faisait plus rapide.
À J237, la surface de la plaie est réduite de moitié. Le travail au petit trot a été repris. Les pansements à la Flammazine ND ont été renouvelés tous les 4 jours.
À J256 (Figure 8), la plaie était quasiment cicatrisée. Les pansements ont été retirés. La jument a été laissée au box avec des bandes de repos et travaille au manège avec des bandes de polo.
À J 269 (Figures 8 et 9), la plaie est considérée cicatrisée. La jument a repris progressivement le travail.
L’examen locomoteur a révélé une discrète réduction de la phase antérieure de la foulée du postérieur droit, mais la jument était capable de travailler à l’obstacle et sur le cross.
DISCUSSION
Prise en charge de plaies appendiculaires complexes
Ce cas complexe est heureusement assez exceptionnel. En pratique courante, la prise en charge initiale peut être compliquée pour le praticien de terrain qui ne dispose pas d’équipements adaptés pour une prise en charge chirurgicale. De la patience et des soins longs sont à prévoir et le budget du propriétaire est à prendre en compte d’autant que le pronostic sportif est incertain dans l’immédiat.
Dans ce cas, tous les soins ont été pratiqués dans une structure disposant d’un bloc chirurgical. L’étape clé d’exploration minutieuse de la plaie, de parage des tissus mortifiés et de drainage a été réalisée sous anesthésie générale. En effet, étant donné le jeune âge et le caractère très affirmé voire dangereux de l’animal, une sédation poussée et une anesthésie jambière n’ont pas permis de réaliser cette opération en toute sécurité sur cheval debout.
Les soins ultérieurs relèvent quasi exclusivement du «dressing» des plaies et peuvent facilement être réalisés sur le terrain. Une bonne sédation est cependant nécessaire dans les premiers jours. La gestion de la douleur au quotidien permet aussi de faciliter les soins. La fréquence de renouvellement des pansements peut être diminuée pour limiter les coûts et s’adapter au mieux aux étapes de la cicatrisation et d’infection.
Les plaies distales sont toujours les plus difficiles à cicatriser car elles sont faiblement vascularisées (Tainturier et Benoit-Godet, 2019) et la réponse inflammatoire est faible et prolongée, ce qui retarde la cicatrisation (Theoret, 2004; Dart et al., 2016a).
Sur ce cas, l’indisponibilité de la jument a été de 9 mois environ, mais elle a pu retrouver une activité de concours complet.
Intérêt du débridement chirurgical
L’exploration chirurgicale initiale de la plaie constitue une étape clé qui peut permettre d’affiner le pronostic en cas de lacération ou de lésion des structures nobles (capsule articulaire, tendons, ligaments, gros vaisseaux). Lors de cette étape, tous les corps étrangers doivent être retirés soit manuellement pour les plus volumineux soit par drainage abondant pour les particules fines. Ces corps étrangers augmentent le risque septique et participent au retard de cicatrisation.
Les plaies des membres, d’autant plus lorsqu’elles sont délabrantes, se caractérisent par une phase inflammatoire prolongée et faible qui les rendrait plus sujettes aux infections (Maher et Kuebelbeck, 2018). Une plaie infectée se caractérise le plus souvent par une légère exsudation purulente voire nauséabonde, ainsi que par la présence d’un tissu de granulation souvent exubérant et de couleur grisâtre anormale (Tucker, 2015; Dart et al., 2016a). Certains auteurs proposent même une évaluation de la qualité de la cicatrisation à partir de la couleur de la plaie et du tissu de cicatrisation afin d’adapter au mieux les soins à apporter (Perrin, 2019).
Dans notre cas, nous avons fait le choix de remettre en place le lambeau cutané afin de repositionner les tissus, d’utiliser le lambeau comme pansement biologique (Geffroy, 2005) et de protéger les structures profondes. L’expérience montre cependant que ce type de lambeau cutané finit le plus souvent par nécroser, au moins partiellement. Il aurait été possible d’en faire l’exérèse afin d’éviter cette nécrose et de limiter la phase de détersion, mais il est difficile d’apprécier la viabilité de certains tissus et donc la surface exacte à extraire au moment de la prise en charge. Par ailleurs, une exérèse, même partielle, ne permet plus de mettre en place des sutures et laisse le lambeau mobile se rétracter. Ceci peut alors ralentir la cicatrisation par deuxième intention. L’exérèse totale crée quant à elle d’emblée une ouverture importante en enlevant certains tissus potentiellement sains et qui auraient permis un gain de temps dans la phase cicatricielle.
En cas de débridement ou de rinçage insuffisant de la plaie, le risque associé à cette reconstruction est d’enfermer des germes pathogènes dans la plaie, de favoriser l’infection et donc de retarder la cicatrisation. Enfin, la pose d’un drain aurait pu contribuer à mieux gérer l’exsudation induite par l’inflammation et par la phase de détersion.
Au cours de la cicatrisation et d’autant plus lorsque celle-ci est longue, le tissu de granulation a tendance à devenir exubérant. Deux types d’interventions sont alors envisageables. Soit l’approche chirurgicale est envisagée et consiste à parer le bourgeon pour l’abaisser au niveau des marges de la plaie. Soit on peut envisager l’utilisation de produits caustiques (sulfate de cuivre, nitrate d’argent, etc.) lesquels retarderaient la cicatrisation et favoriseraient à leur tour la formation d’un tissu de granulation exubérant (Tainturier et al., 2019). En effet, les produits caustiques provoquent la nécrose du tissu de granulation, laquelle augmenterait la réponse inflammatoire ce qui conduirait à inhiber la contraction de la plaie et l’épithélialisation et à stimuler la formation de tissu de granulation. Le résultat obtenu visuellement à court terme serait néfaste à moyen terme pour la cicatrisation (Tainturier et al., 2019).
De la même manière, l’immobilisation partielle du membre, par un bandage qui serait compressif sur la plaie, favorise l’anaérobiose et le bourgeonnement et se révèle donc contre-productif (Wilmink et Weeren, 2004; et Tainturier et al., 2019).
Intérêt de l’immobilisation
Les mouvements entraînent des phénomènes de cisaillement sur le tissu de granulation ce qui entretient l’inflammation locale, favorise l’hyper-granulation et participe au retard de cicatrisation. Les plaies en regard des articulations sont les plus exposées au mouvement et cicatrisent plus lentement que les plaies situées sur la face dorsale du canon (Wilmink et Weeren, 2004). Il est ainsi indispensable d’immobiliser correctement le membre afin d’obtenir la meilleure cicatrisation possible.
Dans notre cas, la plaie n’intéressait que la face dorso-médiale du canon et ne se trouvait donc pas en regard d’une articulation. Cependant, le tendon extenseur dorsal du doigt, largement disséqué lors du traumatisme, était très mobile à chaque mouvement du pied. Ceci a très probablement contribué à ralentir la cicatrisation, à favoriser l’exsudation et le développement d’un tissu de granulation exubérant. En effet, les mouvements perturbent la formation de nouveaux capillaires sanguins, entravent les dépôts de collagène, s’opposent à la progression du liseré épidermique et entretiennent l’inflammation chronique de la plaie (Dart el al., 2016b).
Le pansement de type Robert-Jones mis en place après la chirurgie n’était pas suffisant pour assurer une immobilisation complète du doigt et ne permettait pas de supprimer les mouvements du tendon (Stockwell, 2005). Son intérêt était de suffisamment contenir la plaie pour empêcher le développement d’un engorgement qui aurait été préjudiciable.
Une immobilisation complète de la partie distale du membre ne peut être obtenue que par la mise en place d’un plâtre ou d’une résine intégrant la totalité du pied. Ce plâtre peut ensuite être coupé en deux afin de pouvoir le défaire pour la réalisation des soins et le remettre en place à l’issue. Dans notre cas, il n’a pas été mis en place en raison du jeune âge de la jument et de son caractère très affirmé majorant le risque d’intolérance au plâtre.
L’utilisation de pansement a cependant ses limites. Outre leur coût lorsqu’ils sont utilisés sur le long terme, ils favorisent l’hypergranulation en conservant la plaie en anaérobiose et en maintenant un environnement humide et acide favorisant la formation d’un tissu de granulation exubérant (Wilmink et Weeren, 2004; Dart el al., 2016b). Afin de limiter ce phénomène, l’utilisation d’un gel de kétansérine (Vulketan ND) ou d’Aloe vera aurait pu donner de bons résultats (Tainturier et al., 2019).
Intérêt de la greffe
La greffe de peau en îlots, utilisée sur ce cas, est une technique facile à mettre en œuvre même sur cheval debout. Il s’agit d’une greffe autologue permettant de s’affranchir des problèmes d’incompatibilité entre donneur et receveur. Le principal objectif de la greffe est d’augmenter la surface d’épiderme à partir duquel l’épithélialisation peut avoir lieu, de manière à accélérer la cicatrisation (Tainturier et al., 2019).
Pour augmenter les chances de réussite, la greffe doit être réalisée sur un tissu de granulation lisse, non exsudatif et dénué d’infection (Blackford, 1993). Le parage du lit receveur et la mise en place d’un pansement stérile et adsorbant 48 h avant la greffe est nécessaire pour augmenter les chances de réussite.
Les greffes en îlots choisies dans ce cas présentent plusieurs avantages:
• Elles nécessitent peu d’expérience et ne demandent aucun matériel onéreux (Booth, 1991);
• Elles sont moins vulnérables aux effets d’une inflammation chronique (Theoret, 2004);
• Elles tolèrent mieux un lit de granulation imparfait (Dahlgren et al., 2006);
• Elles peuvent être employées sur des plaies situées sur des zones très mobiles, pour lesquelles les autres techniques de greffes ne sont pas adaptées (Schumacher, 2005);
• Elles peuvent être réalisées sur cheval debout (Mueller, 2015; Tainturier et al., 2019);
• Il est préférable d’intervenir en binôme: l’un prélève et prépare les greffons, le second prépare le site de greffe et les implante. Ceci permet de réduire considérablement le temps d’intervention qui est contraint par la mise en place du garrot et la durée de la sédation.
Le jour de l’intervention, le tissu de granulation est rincé au sérum physiologique, sans ajout de produits antiseptiques qui pourraient être néfastes à la survie des greffons.
Le tissu de granulation richement vascularisé saigne abondamment lors de la réalisation des puits de greffe à l’aide du biopsy punch. Il est indispensable de réaliser cette intervention après la mise en place d’un garrot et d’assurer une bonne hémostase avant d’introduire le greffon, sous peine de le retrouver dans le pansement dès le lendemain. L’utilisation de cotons-tiges préalablement stérilisés est une solution peu onéreuse et efficace pour assurer localement l’hémostase (Tainturier et al., 2019).
Après la greffe, un pansement anti-adhérent, à base de tulle gras, est mis en place. Plus le site de greffe reste immobile, meilleur est le résultat. Les greffes en punch permettent d’espérer la survie de 60 à 75% des greffons (Mueller, 2015).
Les greffons sont rapidement recouverts par le tissu de granulation. Il faut parer celui-ci après une dizaine de jours afin de laisser réapparaître les greffons viables (Carson-Dunkerley et Hanson, 1997). Un traitement à base d’AINS permet d’éviter l’engorgement et la production de sérosités néfastes aux greffons. L’immobilisation précoce est nécessaire pour protéger les greffons et favoriser leur imbibition par le liquide plasmatique fourni par le lit receveur (Booth, 1991).
Dans notre cas, la greffe a été réalisée précocement sur un tissu de granulation tuméfié et malgré les mouvements du tendon extenseur dorsal du doigt. Un bon nombre de greffons ont quand même pu se développer. L’échec d’une greffe est rarement total. En effet, les greffons agissent comme des pansements biologiques qui influent favorablement sur la cicatrisation de la plaie. La réalisation d’une greffe sur une plaie bourgeonnante stimule la contraction de la plaie et l’épithélialisation à partir des marges de la plaie, même en cas d’échec apparent (Carson-Dunkerley et Hanson, 1997; Dahlgren et al., 2006).
Intérêt du suivi radiographique
Lors de lacération du membre avec atteinte du périoste, voire de la corticale osseuse, nous avons pu constater sur différents cas que de nombreux ostéophytes se développent dans les semaines suivantes sur les sites lésés. En effet, le périoste ayant une fonction d’irrigation de la couche superficielle du cortex osseux, on peut s’attendre à une ischémie superficielle en cas de disparition de celui-ci, ce qui peut provoquer une nécrose (Desmaizieres, 2005) et des remaniements osseux ultérieurs.
Ces ostéophytes ne sont pas visibles pour le praticien car recouverts du tissu de granulation. Leur développement, parfois très important, peut irriter le tissu de cicatrisation, favoriser le phénomène inflammatoire et la production d’exsudats et être source de démangeaisons pouvant aboutir à des comportements d’automutilation. Leur présence est responsable d’un retard de cicatrisation. Il est parfois nécessaire de les supprimer par abord chirurgical afin de permettre une cicatrisation normale.
Toute plaie ayant provoqué une atteinte périostée et/ou osseuse, et présentant un retard de cicatrisation avec notamment la production d’un tissu de granulation exubérant éventuellement associée à des comportements d’automutilation, doit faire l’objet de contrôles radiographiques afin d’envisager une éventuelle exérèse chirurgicale des ostéophytes.
Dans notre cas, des ostéophytes peu volumineux se sont développés sur tout le pourtour du canon mais leur développement s’est rapidement atténué. L’utilisation à plusieurs reprises de traitements à base d’anti-inflammatoires stéroïdiens par voie générale et locale a certainement limité cette ostéoprolifération.
Intérêt de la remise au travail
La cicatrisation de la plaie est optimisée par l’absence de mouvements. La marche est donc prohibée dans les premiers temps de la cicatrisation (Tainturier et al., 2019).
Cependant, l’activité physique contrôlée (marche en main 5 minutes à partir de J180) a semblé, dans notre cas, améliorer la cicatrisation en accélérant la phase de contraction.
De plus l’activité physique favorise probablement la circulation sanguine du membre, facilitant ainsi le drainage lymphatique ce qui réduit l’engorgement et participe à l’amélioration du phénomène de contraction de la plaie.
CONCLUSION
Les plaies cutanées complexes sont très souvent déstabilisantes pour le praticien et sources d’inquiétude pour le propriétaire tant en termes de coût de traitement que de pronostic sportif notamment.
Des soins relativement simples, une bonne observance des traitements et des grandes règles de prise en charge des plaies ont permis d’obtenir des résultats très satisfaisants pour un coût acceptable.
Une plaie complexe doit être explorée avec minutie, largement drainée, nettoyée, et débarrassée de tous corps étrangers lors de sa prise en charge. L’utilisation et le type de pansement sont à adapter au stade de cicatrisation. La greffe cutanée peut facilement être mise en œuvre sur cheval debout et favorise à moyen terme la cicatrisation même si un grand nombre de greffons semblent être rejetés. Des ostéophytes peuvent se développer sur toute surface osseuse lésée. Ceux-ci favorisent le retard voire l’absence de cicatrisation et devront être recherchés avant de conclure à un pronostic défavorable. Outre la gestion de la douleur, l’utilisation de traitements anti-inflammatoires peut limiter le développement d’ostéophytes et éviter d’avoir recours à une exérèse chirurgicale.
BIBLIOGRAPHIE
Blackford J.T. (1993). Skin grafting in horses. Eq. Pract., 15: 25-30
Booth L. (1991). Equine wound reconstruction using free skin grafting. Calif. Vet., 45: 13-6.
Carson-Dunkerley S.A., Hanson R.R. (1997). Equine skin grafting: principles and field applications. Compend. Cont. Educ. Pract. Vet., 19: 872-881.
Dahlgren L.A., Booth L.C., Reinertson, E.L. (2006). How to perform pinch/punch grafts for the treatment of granulating wounds in the horse. Department of Large Animal Clinical Sciences, Virginia–Maryland Regional College of Veterinary Medicine, Phase II, Duck Pond Drive, Blacksburg, VA, USA, LC Booth and EL Reinertson, Veterinary Teaching Hospital, College of Veterinary Medicine, Iowa State University, USA P, 53: 116-1206.
Dart, A. J., Sole-Guitart, A., Stashak, T. S.,, Theoret, C. (2016a). Selected factors that negatively impact healing. Equine wound management, 30-46.
Dart A.J., Sole‐Guitart, A., Stashak, T.S., Theoret, C. (2016b). Management practices that influence wound infection and healing. Equine wound management, 47-74.
Desmaizieres L-M. (2005). Démarche diagnostique lors d’atteinte des plans profonds chez le cheval. Le Nouv. Prat. Vet. éq., 4: 9-13.
Geffroy O. (2005). Consultation initiale: les premiers soins lors de plaies chez les équidés. Le Nouv. Prat. Vet. éq., 4: 34-36.
Maher M., Kuebelbeck L. (2018). Nonhealing wounds of the equine limb. Vet. Clin. North. Am. Equine Pract., 34: 539-555.
Mueller P. E. (2015). How I perform an island (punch/pinch) skin graft. In Proceedings of the 61st Annual Convention of the American Association of Equine Practitioners, Las Vegas, Nevada, USA, December 5-9, 2015 (pp. 217-222). American Association of Equine Practitioners (AAEP).
Perrin R. (2019). Évaluation «colorielle» d’une plaie chez le cheval. Prat. Vet. Equine, 202: 58-61.
Schumacher J. (2015). Practical techniques of skin grafting horses that you can perform in your practice. In Proceedings of the 61st Annual Convention of the American Association of Equine Practitioners, Las Vegas, Nevada, USA, December 5-9, 2015 (pp. 1-8). American Association of Equine Practitioners (AAEP).
Stockwell C. (2005). Bandages et immobilisation des plaies par une attelle en résine. Le Nouv. Prat. Vet. éq., 4: 53-55.
Tainturier B., Benoit-Godet C. (2019). Les plaies chroniques chez le cheval. Le Nouv. Prat. Vet. éq., 13:7-12.
Tainturier B., Gouzer V., Santinelli Y. (2019). Les greffes cutanées chez le cheval, Le Nouv. Prat. Vét. Eq., 13: 31-40.
Theoret C.L. (2004). Wound repair in the horse: problems and proposed innovative solutions. Clin. Techn. Equine Pract., 3:134-140.
Tucker R. (2015). Non healing wounds of the equine distal limb – effective field surgery techniques. Livestock, 20: 225-231.
Wilmink J.M., Weeren P.R. (2004). Treatment of exuberant granulation tissue. Clin. Techn. Equine Pract., 3:141-147.
Publié-e
Comment citer
Numéro
Rubrique
Licence

Revue Marocaine des Sciences Agronomiques et Vétérinaires est mis à disposition selon les termes de la licence Creative Commons Attribution - Pas d’Utilisation Commerciale - Partage dans les Mêmes Conditions 4.0 International.
Fondé(e) sur une œuvre à www.agrimaroc.org.
Les autorisations au-delà du champ de cette licence peuvent être obtenues à www.agrimaroc.org.

