Caractérisation de Trypanosoma sp chez les animaux domestiques dans quatre foyers de la partie Ouest de la République Démocratique du Congo (RDC)
Résumé
En vue d’identifier les trypanosomes circulants chez les animaux domestiques de Kinshasa, Mbanza-Ngungu, Masi-Manimba et Mushie et d’en déterminer les prévalences par PCR, une étude longitudinale a été menée. 1653 échantillons sanguins ont été prélevés chez les animaux domestiques dans les foyers de Kinshasa, Mbanza-Ngungu, Masi-Manimba et Mushie, dont 22 cas ont été positif au Trypanosoma congolense Forest, correspondant à une prévalence brute de 1,3%. Pour ce qui est des foyers, Kinshasa a eu une prévalence de 2,5%, Mbanza-Ngungu une prévalence de 2,4%, Masi-Manimba sans aucune prévalence et Mushie une prévalence de 1,3%. En rapport avec les saisons, la saison de pluie a eu une prévalence de 1,4%, alors que la saison sèche en a eu 1,3%. Concernant les espèces, les bovins ont eu une prévalence de 0,9%, les porcins une prévalence de 3,7%, les ovins une prévalence de 1,4% et les caprins une prévalence de 0,7%. Quant au sexe, les mâles ont eu une prévalence de 0,9%, alors que les femelles en ont eu 1,5%. Cette étude a montré que la Trypanosomiase Animale Africaine (TAA) serait en recul chez les animaux de ces quatre foyers. Ainsi, les cliniciens sur terrain devraient réorienter leur stratégie thérapeutique, en intégrant cette nouvelle donne.
Mots clés: Trypanosoma sp, Animaux domestiques, Ouest RDC
Téléchargements
Introduction
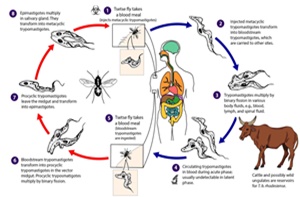
Dans le domaine vétérinaire, la trypanosomose est une maladie parasitaire provoquée par un parasite protozoaire flagellé sanguicole exo-érythrocytaire appelé trypanosome, du genre Trypanosoma. Il s’agit d’une maladie a transmission vectorielle dont le vecteur cyclique est la glossine ou mouche tsé-tsé du genre Glossina (Mallaye et al., 2014).
Cette transmission active peut être renforcée par une transmission mécanique assurée par les Stomoxyinidae, des Tabanidae et quelques Hyppoboscidae qui maintiennent l’incidence de la maladie, même dans des aires dépourvues des glossines (Desquesnes et al., 2005; Sinshaw et al., 2006).
En Afrique, ces espèces sont transmises par divers insectes hématophages, dont les plus importants sont les glossines ou mouches tsé-tsé, qui constituent l’hôte intermédiaire véritable de ces parasites. Les mouches tsé-tsé, insectes exclusivement africains, occupent, sur ce continent, une superficie de près de 10 millions de Km2, s’étendant de part et d’autre de l’équateur, depuis le 15ème degré de latitude Nord jusque vers le 20ème degré latitude Sud (Itard, 1981).
La trypanosomiase animale africaine (TAA) reste largement répandue. Environ 60 millions des bovins, 100 millions des petits ruminants et d’autres espèces animales sont menacées dans cette zone de l’Afrique, avec des pertes annuelles considérables de viandes estimées à près de 5 milliards de dollars US (Geerts et al., 2001; Mortelmans, 1986; Trail et al., 1985).
Selon l’OMS (2017), la RDC reste le pays le plus affecté par la trypanosomiase humaine africaine (THA) avec plus de 70 % des malades dont la plus part proviennent des foyers de l’Ouest du Pays.
Si du côté humain, les statistiques de la prévalence de le THA sont disponibles, elles font souvent défauts du côté vétérinaire. Cependant, beaucoup d’élevage à l’Ouest de la RDC incriminent la TAA comme la première cause de mortalité dans leurs exploitations, c’est le cas du ranch de Mushie qui est le plus grand ranch à l’Ouest de la RDC dont la TAA a constitué en 2013 la première cause de mortalité représentant 13%.
Les études réalisées par ILCA (1986) ont prouvé l’inexistence des trypanosomes chez les bovins N’dama à Kolo au Kongo-Central, par contre à Mushie dans la Province de Mayi-Ndombe, la prévalence de la trypanosomose chez les bovins N’dama a été de 7,5%, avec prédominance de T. vivax, suivie de T. congolense et de T. brucei brucei.
Sumbu et al. (2009) ont démontré que dans certains quartiers de Kinshasa que la TAA est un réel problème pour l’élevage porcin. Au total, dans 38 % des fermes prospectées, les animaux ont été trouvé positifs au diagnostic d’ELISA. Les fermes présentant des cas parasitologiquement confirmés (6% de toutes les fermes prospectées) se situaient essentiellement dans la Commune de Mont Ngafula. T. simiae, T. vivax, T. congolense et dans une moindre mesure, T. brucei brucei et T. brucei gambiense ont été identifiés.
Les études réalisées par ILCA (1986) ont prouvé l’inexistence des trypanosomes chez les bovins N’dama à Kolo au Kongo-Central.
Les investigations menées chez les caprins du Kongo Central par Tshilenge et al. (2015), ont prouvé que la prévalence de la TAA est de 12,8 % pour T. congolense, dont 20 % à Kimpika et 4 % à Sanda; 5,6 % pour T. vivax, dont 12 % à Sanda et 4 % à Kimpika et à Kimpungi; et enfin 4 % pour T. brucei brucei avec 8 % à Kimpika et 4 % à Kasangulu, Kimpungi et Sanda. Simo et al. (2012) ont mis en évidence T. congolense Savannah, T. brucei, T. congolense Forest et T. vivax chez Glossina palpalis palpalis à Kimpese au Kongo-Central.
La présente étude consiste à identifier les espèces et les souches de trypanosomes affectant les animaux domestiques dans les foyers de la TAA à Mushie, Masi-Manimba, Mbanza-Ngungu et Kinshasa dans la partie Ouest de la RDC et d’en évaluer les prévalences.
Matériel et méthodes
Milieu d’étude
Cette étude a été réalisée durant quatre ans, de 2013 à 2016 dans les foyers de Kinshasa à Kimwenza (Latitude: 4° 27’ 33’’ S et Longitude: 15° 17’ 20’’ E) et à N’Djili Brasseries (Latitude: 04° 48’ 08’’ S et Longitude: 15° 30’ 43’’ E), de Mbanza-Ngungu (Latitude: 05° 27’ 127’’ S et Longitude: 014° 97’ 173’’ E) dans la Province du Kongo-Central, du ranch de Mushie (Latitude: 02° 09’ à 2° 95’ et Longitude: 17° 45’ E) dans la Province de Mayi-Ndombe et de Masi-Manimba (Latitude: 04° 73’ 925’’ S et Longitude: 017° 87’ 997’’ E) dans la Province de Kwilu à l’Ouest de la RDC (Figure 7).
N’Djili- Brasseries est un quartier de la commune de la N’Sele, à 35 km du centre-ville dans la périphérie Est de Kinshasa. N’Djili-Brasseries est un quartier où l’activité humaine y est intense et dont la population vit des cultures maraîchères et vivrières ainsi que de l’élevage dont le plus important est celui des porcs. La végétation de la zone est essentiellement constituée de la savane herbeuse parsemée d’arbustes, de galeries forestières dégradées ou conservées par endroit et de lambeaux forestiers marécageux. Il est drainé par la rivière N’Djili.
Le quartier Kimwenza est situé dans la commune de Mont-Ngafula, sur les collines de l’Ouest de la ville de Kinshasa. Le quartier Kimwenza est délimité au Nord par le quartier Cité verte, à l’Ouest par la localité de Tshilombo, à l’Est par le quartier Kindele et au Sud par la ferme Takizala. Les activités humaines, le climat et la végétation ressemblent à ceux de N’Djili-Brasseries. Il est drainé par la rivière Lukaya.
Située au centre du Secteur Boko dans le territoire de Mbanza-Ngungu, la ville de Mbanza-Ngungu est bornée à l’Est par le Groupement Kifua, au Nord par le Groupement Kiazi, à l’Ouest et au Sud par le Groupement Luvaka, tous du Secteur Boko. Elle est le chef-lieu du district des Cataractes, dans la province du Bas-Congo. Cette ville a une superficie de 93 Km2, traversée par la nationale n°1 et est située à 154 km de Kinshasa et à 211 km de la ville portuaire de Matadi. La ville est située dans une région de collines et de vallons. Un belvédère y culmine à 785 mètres d’altitude. En raison de son altitude élevée, Mbanza-Ngungu présente un climat tropical frais et humide qui permet certaines cultures maraîchères occidentales, notamment la fraise. La végétation est constituée d’une savane arbustive.
Mushie est situé à 231 Km de Kinshasa dans la zone équatoriale, caractérisée par l’absence d’une saison sèche régulière. La végétation est constituée d’une forêt équatoriale.
Masi-Manimba est situé à 120 kilomètres, au Sud de la ville de Kikwit et à environ 130 kilomètres de la capitale Kinshasa, dans la zone tropicale avec deux saisons bien marquée, avec neuf mois de saison de pluie et trois mois de saison sèche. La végétation est constituée d’une savane herbeuse à hautes herbes, entre coupée des forêts galeries.
Quant aux analyses de laboratoire, elles ont été menées à l’Institut National de Recherche Biomédicale (INRB) pour l’extraction de l’ADN et au Laboratoire vétérinaire à Kinshasa pour la PCR.
Prélèvement d’échantillons
A l’aide des kits vacutainers, l’aiguille vacutainer a été enfoncée dans la veine jugulaire chez les bovins, les ovins et les caprins ou dans la veine auriculaire chez les porcins. Le sang a ainsi été recueilli dans le tube vacutainer contenant un anticoagulant.
Les sangs ont été mis sur les papiers filtres Whatman 1 comportant le code de l’animal, le lieu et la date de prélèvement. Par la suite, les papiers filtres ont été séchés à l’air ambiant puis, gardé dans les enveloppes au réfrigérateur en attendant les analyses.
Extraction de l’ADN
L’extraction de l’ADN s’est basée sur le protocole Chelex tel que décrit par Geysen et al. (2003) à partir des confettis de 3 mm issus de papiers filtres. L’ADN a été conservé à moins 20°C, après extraction.
PCR et Nested PCR
La PCR, dite Nested PCR, fait intervenir une seconde PCR réalisée en utilisant des nouvelles amorces situées à l’intérieur du fragment nucléotidique obtenu avec le premier couple d’amorces. Le fragment à amplifier lors de la seconde PCR est plus court, ce qui réduit par conséquent les hybridations non spécifiques (Viljoen et al., 2005). Cette étude a utilisée 3 amorces qui sont: 18ST nF2 (CAA CGA TGA CAC CCA TGA ATT GGG GA), 18ST nR3 (GTC TCT TGT CAC TGA CAT TCT AGT G) et 18ST nR3 (TGC GCG ACC AAT AAT TGC AAT AC) ciblant les gènes ribosomiales pour une recherche de variation intra spécifique (Geysen et al., 2003). La nested PCR a été effectuée en deux rounds: le premier round a été exécuté avec un volume réactionnel de 25 µl dont 5 µl de l’extrait ADN de l’échantillon, 1,6 µl de MgCl2 (25 mM), 5 µl de 5X colorless Go Taq, 0,5 µl de chacun des 4 dNTP, 0,4 µl de 5U Go Taq DNA polymerase, 10,2 µl d’eau de biologie moléculaire, 0,4 µl de chaque primer (Geysen et al., 2003). Les échantillons ont été amplifiés dans un thermocycler Master cycler gradient de marque Eppendorf en passant par les étapes suivantes: dénaturation initiale à 94°C pendant 4 minutes, dénaturation à 92°C pendant 30 secondes, hybridation à 58°C pendant 1 minute pour 39 cycles et une élongation finale à 72°C pendant 8 minutes. Après le premier round, une semi-nested amplification a été réalisée en utilisant les amorces 18ST nF2 et 18ST nR2 avec un volume réactionnel de 24,5 µl auxquels on ajoute 0,5 µl de produits PCR du Premier tour (Geysen et al., 2003). L’ITS-PCR développée par Desquesnes et al. (2001) permet la détection et l'identification simultanées des différentes espèces des trypanosomes affectant les animaux, en utilisant une paire d’amorces spécifiques ciblant la région 18S et 5n8S rDNA: Kin 1 (GCG TTC AAA GAT TGG GCA AT et Kin 2 (CGC CCG AAA GTT CAC C). L’ITS-PCR a donc été réalisée dans un volume réactionnel de 25 µl contenant 5 µl de l’ADN de chaque échantillon, 50 mM de KCl, 10 mM de Tris-HCl (pH: 8,3), 1,5 mM de MgCl2, 200 µM de chaque dNTP, 20 uM de chaque primer (Kin 1 et Kin 2) et 0,5 U de l’enzyme Taq polymerase, 50 µl d’huile minérale (Sigma) ont été ajoutés au volume réactionnel et placés dans le bloc de chauffage de thermocycler. Après dénaturation pendant 4 minutes à 94 °C, l’amplification a été faite pendant 40 cycles qui ont consistée à 94°C pendant 30 secondes de dénaturation, 59°C pendant 45 secondes d’hybridation et 1 minute d’élongation à 72°C suivi d’une élongation finale à 72°C pendant 5 minutes. Ensuite, 5 µl de chaque produit PCR et 3 µl de tampon de charge (Loading Dye 6x) ont été déposés sur gel agarose 2% (Bromure d’éthidium). La lecture a été faite sur une table ultra violette.
Analyses statistiques
Les données ont été encodées en Excel et le logiciel Stata 10 a été utilisé pour effectuer tous les tests statistiques. Niveau de précision a été maintenue à 95% et P ≥ 0,05 ensemble pour la signification.
Résultats
1653 échantillons sanguins ont été prélevé chez les animaux domestiques dans les foyers de Kinshasa, Mbanza-Ngungu, Masi-Manimba et Mushie, dont 22 cas ont été positifs au Trypanosoma congolense Forest, correspondant à une prévalence brute de 1,3% (Tableau 1, 2, 3, 4 et Figure 1).
Prévalence de T. congolense Forest chez les animaux domestiques en fonction des sites
Pour ce qui est des foyers, Kinshasa a eu une prévalence de 2,5%, Mbanza-Ngungu en a eu de 2,4%, Masi-Manimba n’a eu aucune prévalence et Mushie en a eu de 1,3% (Tableau 1). La différence n’a pas été significative.
Prévalence de T. congolense Forest chez les animaux domestiques en fonction des saisons
En rapport avec les saisons, la saison de pluie a eu une prévalence de 1,4%, alors que la saison sèche en a eu de 1,3%. La différence a été significative.
Prévalence de T. congolense Forest chez les animaux domestiques en fonctions des espèces
Concernant les espèces, les bovins ont eu une prévalence de 0,9%, les porcins en ont eu de 3,7%, les ovins en ont eu de 1,4% et les caprins en ont eu de 0,7% (Tableau III). La différence n’a pas été significative.
Prévalence de T. congolense Forest chez les animaux domestiques en fonction du sexe
Quant au sexe, les mâles ont eu une prévalence de 0,9%, alors que les femelles en ont eu de 1,5%. La différence a été significative.
Discussion
Les résultats du Tableau 1, ont montré que Kinshasa a été le site le plus affecté par la TAA avec une prévalence de 2,5%, suivi de Mbanza-Ngungu avec 2,4% et de Mushie avec 1,3%. En revanche, aucun cas n’a été diagnostiqué à Masi-Manimba. La faiblesse ou l’absence de la prévalence de la TAA dans ces quatre sites de l’Ouest de la RDC semble indiquer que les notifications alarmantes sur la TAA des cliniciens des élevages de cette partie de la République, faisant de la TAA la première cause de la mortalité et de la morbidité, ne refléteraient pas la réalité. Par contre, ces résultats tendent à montrer que la prévalence de la TAA est sensiblement en recul, ce qui pourrait s’expliquer par la lutte sans relâche contre les glossines par le Programme national de Lutte contre la Trypanosomiase Humaine Africaine, réduisant sensiblement la densité glossinaire dans les foyers, par la déforestation pour la production des charbons de bois et par une urbanisation galopante des milieux urbano-rurales, détruisant ainsi les gites des glossines et également par la chimiothérapie appliquée sur les animaux par les éleveurs.
Seule T. congolense Forest a été diagnostiqué dans ces trois foyers de TAA. Alors que les études parasitologiques réalisées par ILCA (1986) ont prouvé l’existence de T. vivax, suivie de T. congolense et de T. brucei brucei avec une prévalence de 7,5% chez les bovins N’dama à Mushie et ceux de Sumbu et al. (2009) ont identifiés T. simiae, T. vivax, T. congolense, T. brucei brucei et T. brucei gambiense chez les porcs de Kimwenza dans la Commune de Mont Ngafula à Kinshasa. Plus à l’Ouest, au Kongo Central ILCA (1986) a prouvé l’inexistence des trypanosomes chez les bovins N’dama à Kolo; Tshilenge et al. (2015), ont prouvé que la prévalence de la TAA est de 12,8 % pour T. congolense, dont 20 % à Kimpika et 4 % à Sanda; 5,6 % pour T. vivax, dont 12 % à Sanda et 4 % à Kimpika et à Kimpungi; et enfin 4 % pour T. brucei brucei avec 8 % à Kimpika et 4 % à Kasangulu, Kimpungi et Sanda et Simo et al. (2012) ont mis en évidence T. congolense Savannah, T. brucei, T. congolense Forest et T. vivax chez Glossina palpalis palpalis à Kimpese.
Une espèce plus pathogène s’élimine soit par un traitement de l’animal suite à la présentation des symptômes, soit par la mort de l’animal affecté (Rodhain et Perez, 1985). Bengaly et al. (2002 a,b) ont rapporté que T. congolense Forest était peu pathogène, sans expression clinique de la maladie, raison pour laquelle cette souche de T. congolense Forest continue à circuler chez les animaux.
Le Tableau 2 a montré que la saison de pluie a été la plus affectée avec une prévalence de 1,4%, contre une prévalence de 1,3% en saison sèche. La différence a été significative, due au fait que la densité glossinaire est plus élevée en saison de pluie qu’en saison sèche (Rodhain et Perez, 1985).
Le Tableau 3 a montré que les porcins ont été les plus affecté avec une prévalence de 3,7%, suivi des ovins avec 1,4%, des bovins avec 0,9% et des caprins avec 0,7%. Lombe et al. (2013) ont montré que les porcins constituent un hôte nourricier important pour les glossines dans la zone périurbaine de Kinshasa.
Le Tableau 4 a montré que, les mâles ont eu une prévalence de 0,9% alors que les femelles en ont eu de 1,5%, avec une différence significative. Euzeby (1997) a indiqué que l’état physiologique des femelles peut avoir une influence sur le degré de sensibilité de l’animal aux pathologies.
Les résultats de cette étude ont démontré la limite du diagnostic clinique qui n’est que présomptif. La TAA n’ayant pas de symptôme pathognomonique et dont les symptômes peuvent porter confusion avec certaines maladies à tiques et certaines verminoses, il se pourrait que toutes ces maladies soient diagnostiquées comme la TAA.
Ainsi, les cliniciens sur terrain devraient réorienter leur stratégie thérapeutique en intégrant cette nouvelle donne.
Donc, le ranch de Mushie par exemple qui dépense annuellement environ 10.475 dollars américains pour l’achat de 1.600 sachets de Veriben (Diminazène) et 1775 sachets de Veridium (Isométamidium) pour assurer la prophylaxie des 27.000 bovins du ranch, pourrait réorienter une partie de ces fonds dans la lutte contre les autres pathologies qui peuvent porter confusion avec la TAA. Pour ce qui est de la lutte contre la TAA, il faudrait se focaliser uniquement sur le traitement curatif que de procéder à un traitement prophylactique, puisqu’une espèce peu virulente de trypanosome comme c’est le cas avec Trypanosoma congolense Forest, assure une immunité croisée contre celles qui ont une virulence plus élevée. Alors que les éliminer par un traitement prophylactique systématique, exposerait les animaux.
Conclusion
La présente étude a révélé que la TAA serait en recul chez les animaux domestiques de Kinshasa, Mbanza-Ngungu et Mushie et qu’elle serait inexistante chez ceux de Masi-Manimba.
Les trypanosomes mis en évidence étant réputés être moins pathogènes pour les animaux domestiques, une conception et une mise en œuvre d’une nouvelle stratégie de contrôle se concentrant sur la lutte anti-vectorielle et la chimiothérapie limité aux malades s’impose.
Références
Bengaly Z., Ganaba R., Sidibe I., Desquesnes M., Boly H and Santodogo L. (2002a). Comparative pathogenicity of three genetically distinct types of Trypanosoma congolense in cattle: Clinical observations and haematological changes. Veterinary Parasitology, 108: 1-19.
Bengaly Z., Sidibe I., Boly H., Samadogo L., Desquesnes M. (2002b). Comparative pathogenicity of three genetically distinct Trypanosoma congolense types in inbred Balb/c mice. Veterinary Parasitology, 105: 111-118.
Desquesnes M., Mc Laughlin G., Zoungrana A., Davilla A. (2001). Detection and identification of trypanosome of African livestock through a single PCR based on internal transcribed spacer 1 of ADN. International journal of parasitology, 31: 610-614.
Desquesnes M., Dia M.L., Acapovi G., Yoni W. (2005). Les vecteurs mécaniques des trypanosomes animals: généralités, morphologie, biologie, impact et contrôle. Identification des espèces les plus abondantes en Afrique de l’Ouest, Bobo Dioulasso, Burkina Faso, Cirdes, 67 pp.
Euzeby J. (1997). Les sarcocystoses zoonotiques, Bull. Soc. Pathol. Exot., 90: 200.
Geerts S., Holnes P.H., Diall O., Eisler C. (2001). African bovine trypanosomiasis: the problem of drug resistance. Trends in Parasitology, 17: 25-28.
Geysen D., Delespaux V., Geerts S. (2003). PCR-RFLP Using Ssu-rDNA Amplification as an Easy Method for Species-Specific Diagnosis of Trypanosoma Species in Cattle. Veterinary Parasitology, 110 : 171-180.
ILCA (1986). The ILCA/ILRAD Trypanotolerance Network, International Livestock centre for Africa, Addis Ababa, Ethiopia, 95 pp.
Itard J. 1981). Les trypanosomoses animales africaines, Précis de Parasitologie vétérinaire tropicale (Troncy P.M., Itard J. et Morel P.C.), Ministère de la Coopération et du développement, IEMVT, Paris, France, 305-469.
Lombe B., Sumbu J., Masumu J., Mpiana S., Thilenge G., Mande J., Makumbu T., Marcotty T., Abatih E., Berkvens D., Boelaert M., De Deken R. (2013). Evaluation de l’efficacité de la fluméthrine dans la lute contre les glossines à Lutendele, République Démocratique du Congo. Rev. Elev. Méd. Vét. Pays Trop., 66: 123-130.
Mallaye P., Kahagne L., Ndeledje N., Louis F.J., Maamat H. (2014). Transmission concomitante de trypanosome humaine et animale: le foyer de Mandoul au Tchad. Rev. Elev. Méd. Vét. Pays Trop., 67: 5-12.
Mortelmans J. (1986). Quelques aspects économiques en rapport avec la parasitologie vétérinaire. Tropicultura, 4: 112-116.
OMS (2017). Trypanosomiase humaine africaine (maladie du sommeil), Aide-mémoire N°259 janvier, 5 pp.
Rhodhain F., Perez C. (1985). Précis d’entomologie médicale et vétérinaire, Ed. Maloise, Paris, France, 458 pp.
Simo G., Silatsa B., Njiokou F., Lutuma P., Madinga J., Manzanbi E., De Deken P., Asonganyi T. (2012). Identification of different trypanosomes species in the mid-guts of tsetse flies of Malanga (Kimpese) sleeping sickness focus of the Democratic Republic of Congo, Parasites and vectors, 5 :201.
Sinshaw A., Abebe G., Desquesnes M., Yoni W. (2006). Biting flies and Trypanosoma vivax infection in three highland district bordering Lake Tana. Ethiopia Vet. Parasitol., 142: 35-46.
Sumbu J., De Deken R., Deckers N., Mpiana S., Kabambi P., Tshilenge G., Boelaert M. (2009). Variation spatiale du risque pour les porcs de contracter la trypanosomose dans la zone periurbaine de Kinshasa. Parasite, 16: 153-159.
Trail J.C.M., Murray M., Sones K., Jibbo J.M.C., Darkin J., Ligth D. (1985). Boran cattle maintained by chemorprophylaxis under trypanosomiasis risk. Journal of Agricultural Science, 105: 147-166.
Tshilenge G., Balowa K.L., Tshinguta L.C., Kazadi K.E., Bha G., Ndadi N.V., Mukalakata N.T., Mpiana T.S., Madinba K.C.Y. (2015). Identification de Trypanosoma spp chez la chèvre dans la province du Bas-Congo. Congosciences, 3:115-119.
Viljoen G.J. Nel L.H., Crowther J.R. (2005). Molecular diagnostic PCR Handbook, AIEA/FAO, Springer, Netherland.
Publié-e
Comment citer
Numéro
Rubrique
Licence

Revue Marocaine des Sciences Agronomiques et Vétérinaires est mis à disposition selon les termes de la licence Creative Commons Attribution - Pas d’Utilisation Commerciale - Partage dans les Mêmes Conditions 4.0 International.
Fondé(e) sur une œuvre à www.agrimaroc.org.
Les autorisations au-delà du champ de cette licence peuvent être obtenues à www.agrimaroc.org.

