Babésiose canine au Maroc: description de deux cas cliniques
Résumé
Deux chiens présentés à la clinique des animaux de compagnie de l’Institut Agronomique et Vétérinaire Hassan II ont été diagnostiqués avec une babésiose. Les chiens ont manifesté de façon aiguë de la fièvre, un abattement et de l’anorexie. D’autres signes cliniques ont été observés incluant vomissement et ictère. Les modifications hémato-biochimiques détectées incluaient une monocytose, une lymphopénie et une thrombocytopénie pour le premier cas, une discrète anémie et une élévation importante de l’activité sérique des phosphatases alcalines pour le deuxième cas. Des inclusions intra-érythrocytaires de piroplasmes ont été détectées à l’examen microscopique des frottis sanguins chez les deux chiens.
Babésiose, Babesia spp., chien, maladies transmises par les tiques, Maroc.
Téléchargements
Introduction
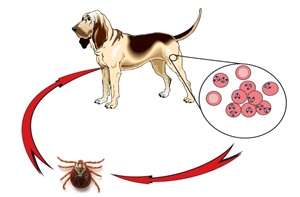
Les babésioses canines sont des maladies infectieuses de répartition mondiale dues à la multi-plication intra-érythrocytaire et à l’action pathogène de protozoaires du genre Babesia, trans-mis naturellement par l’intermédiaire de tiques [Uilenberg, 2006; Irwin, 2009; Solano-Gallego and Baneth, 2011].
Les babésioses sont communément appelées piroplasmoses du fait de l’aspect en forme de poire des inclusions intra-érythrocytaires du parasite responsable détectées à l’examen micros-copique du frottis sanguin [Schoeman, 2009]. Selon leurs morphologies, on divise les Babesia infectant le chien en deux groupes: les grandes et les petites Babesia. Les grandes Babesia (taille des inclusions: 2,4 x 5μm) comprenant les espèces B. canis, B. vogeli et B. rossi. Les petites Babesia incluent différentes espèces dont principalement B. gibsoni, B. microti-like et B. conradae [Kjemtrup et al., 2000; Boozer and Macintire, 2003; Uilenberg G, 2006, Zahler et al., 1998; Carret et al., 1999; Solano-Gallego et al., 2016; Baneth, 2018].
En Europe, la babésiose canine la plus répandue est due à Babesia canis, transmise essentiel-lement par la tique Dermacentor reticulatus [Bourdoiseau, 2006; Solano-Gallego et al., 2016]. En Afrique du Nord, très peu d’études sont disponibles mais semble s’accorder sur le fait que la principale espèce de Babesia détectée est B. vogeli [M’ghirbi et al., 2008; Salem and Farag, 2014; Rjeibi et al., 2016]. Le vector reconnu de cette espèce est Rhipicephalus sanguineus s.l [Irwin, 2009]. En Afrique du Sud et sub-saharienne, les deux espèces les plus fréquentes sont B. rossi (surtout en Afrique du Sud) et B. vogeli (le reste du continent) [Uilenberg et al., 1989; Matjila et al., 2004; Oyamada et al., 2005; Sasaki et al., 2007; Cardoso et al., 2016].
Classiquement, la babésiose canine se manifeste par un syndrome hémolytique (anémie, hémo-globinurie, bilirubinurie, ictère) associé à un syndrome fébrile (abattement, anorexie, hyper-thermie). Toutefois d’autres manifestations cliniques dues à des atteintes organiques localisées ou systémiques ou a une réaction inflammatoire généralisée peuvent existes et sont probable-ment moins connues [Lobetti, 1998; Jacobson and Clark, 1994; Matijatko et al., 2010].
Nous décrivons dans cet articles les deux premiers cas publiés de babésiose canine au Maroc.
Anamnèses et descriptions des signes cliniques
Rocky, chien Husky de Sibérie âgé de deux ans a été admis en consultation pour vomisse-ment, anorexie et abattement évoluant depuis 4 jours. Il vit à l’extérieur avec deux autres chiens qui semblent en bonne santé selon le propriétaire, et est régulièrement promené dans une forêt dans la région de Rabat. A l’examen clinique, Rocky est légèrement abattu sans altération de la vigilance et présente une fièvre modérée (39,6°C) et une pâleur des muqueuses oculaires et gingivales. Les fréquences cardiaque et respiratoire sont de 120 battements par minute et 68 mouvements par minute, respectivement. Aucune anomalie n’a été détectée à l’auscultation cardio-respiratoire ni a la palpation abdominale. Cependant, le chien a présenté des vomissements de couleur blanchâtre lors de la consultation. Des tiques ont été détectées au niveau de ses oreilles et de ses espaces interdigités.
Sacha, chienne Husky de Sibérie âgée d’un an et demi est admise en consultation pour ictère (Photo 1), urines foncées et abattement évoluant depuis 1 semaine. La chienne était par ail-leurs massivement infestée par les tiques depuis près de deux semaines. Elle vit dans une ferme dans la région de Rabat avec deux autres chiens qui n’ont présenté aucun signe clinique selon le propriétaire. A l’examen clinique, Sacha présente un abattement marqué sans altéra-tion de la vigilance, une discrète fièvre (température rectale de 39,3°C) et un ictère franc. Les fréquences cardiaque et respiratoire sont de 120 battements par minute et 40 mouvements par minute, respectivement. Aucune anomalie n’a été détectée à l’auscultation cardio-respiratoire. Les nœuds lymphatiques sous mandibulaires, préscapulaires et poplités sont légèrement hyper-trophiés. De plus, une splénomégalique est suspectée à la palpation abdominale. Une forte infestation par les tiques est notée lors de l’examen.
Photo 1. Muqueuses buccales et oculaires ictériques.
Examens complémentaires
Un bilan sanguin a été réalisé chez les deux chiens incluant un hémogramme, des examens biochimiques sanguins et un examen microscopique du frottis sanguin.
L’hémogramme révèle une discrète monocytose et lymphopénie ainsi qu'une thrombopénie sévère confirmé à l’examen du frottis dans le cas de Rocky (Tableau 1). Aucune anomalie n’a été détectée à l’analyse biochimique. La monocytose peut être due à un processus inflamma-toire, une infection, une toxémie, l’administration de glucocorticoides ou à un processus tumo-ral (leucémie myélomonocytaire aigue/chronique, sarcome histiocytaire) tandis que la lympho-pénie peut être associée à un processus inflammatoire, infectieux, une corticothérapie, des pertes (chylothorax), des atteintes digestives (lymphome, entéropathie exsudatives, néo-plasme, entérite granulomateuse ou ulcérative, paratuberculose, lyphamgiectasie) ou une apla-sie/hypoplasie lymphoïde de la moelle osseuse (traitement immunosuppresseur, radiothérapie, lymphome multicentrique stade 5, lymphadénite généralisée). Le diagnostic différentiel de la thrombocytopénie inclue la baisse de production des plaquettes (infection, néoplasie), l’augmentation de la consommation (CIVD, thrombo-embolies, vascularite, hémagiosarcome), la destruction des plaquettes (thrombocytopénie à médiation immunitaire, infection, syndrome hémophagocytaire/syndrome d’activation macrophagique) ou la perte lors d’hémorragie mas-sive.
Paramètres Valeurs Normes usuelles
(ProCyte DX, IDEXX)
Globules rouges (M/µL) 5,89 5,65 – 8,87
Hématocrite (%) 37,2 37,3 – 61,7
Hémoglobine (g/dL) 14,0 13,1 – 20,5
VGM (fL) 63,2 61,6 – 73,5
TCMH (pg) 23,8 21,2 – 25,9
CCMH (g/dL) 37,6 32,0 – 37,9
IDR (%) 15,4 13,6 – 21,7
%RETIC 0,3 ?
Réticulocytes (K/µL) 18,3 10,0 – 110,0
RETIC-HGB (pg) 18,8 22,3 – 29,6
Globules blancs 6,65 5,05 – 16,76
Polynucléaires neutrophiles (K/µL) 4,33 2,95 – 11,64
Polynucléaires éosinophiles (K/µL) 0,22 0,06 – 1,23
Polynucléaires basophiles (K/µL) 0,01 0,00 – 0,10
Lymphocytes (K/µL) 0,94 1,05 – 5,10
Monocytes (K/µL) 1,15 0,16 – 1,12
Plaquettes (K/µL) 9 148 - 484
Tableau 1. Résultats des examens hématologiques de Rocky.
Paramètres Valeurs Normes usuelles
(Catalyst One, IDEXX)
GLU (mg/dL) 94 67 – 147
CREA (mg/dL) 0,9 0,5 – 1,5
UREE (mg/dL) 10 7 – 27
BUN/CREA 10 ?
PHOSP (mg/dL) 4 2,5 – 6,8
Ca (mg/dL) 10 7,9 – 12,0
PT (g/dL) 7,2 5,2 – 8,2
ALB (g/dL) 3,1 2,3 – 4,0
GLOB (g/dL) 4,2 2,5 – 4,5
ALB/GLOB 0,7
ALAT (U/L) 58 10 – 125
PAL (U/L) 90 23 – 212
GGT (U/L) 3 0 – 11
TBIL (mg/dL) 0,4 0,0 – 0,9
CHOL (mg/dL) 147 110 – 320
AMYL (U/L) 906 500 – 1500
LIPA (U/L) 445 200 – 1800
Tableau 2. Résultats des examens biochimiques sanguins de Rocky.
L’hémogramme de Sasha a permis de mettre en évidence une discrète anémie et une légère leucocytose neutrophilique (Tableau 3). Cependant, cet hémogramme doit être interprété avec prudence car réalisé dans un laboratoire d’analyse médicale humain dont les automates ne sont pas calibrés pour les animaux de compagnie pouvant ainsi engendrer des modifications arté-factuelles du comptage cellulaire. L’examen biochimique a permis de mettre en évidence une discrète augmentation de l’alanine aminotransférase (ALAT) et une forte élévation de l’activité sérique des phosphatases alkalines (PAL) (Tableau 4). La discrète anémie même si elle est d’origine hémolytique, ne peut seule expliquer l’ictère important et une origine hépatique ou post-hépatique (hépatite, lipidose, tumeur hépatique/pancréatique, cholangite, cholan-giohépatite, lithiase cholangite, cholécystite, lithiases biliaires, rupture des voies biliaires ou pancréatite) a été suspectée. Les principales causes d’élévation des PAL sont les affections induisants une cholestase intra ou extra-hépatique qui peuvent être dégénératives, métabo-liques (lipidose, diabète sucré, l’hyperadrénocorticisme, l’hyperthyroïdie, lithiases), inflamma-toires (hépatite, cholangite, pancréatite), tumorales (carcinome des voies biliaires, carcinome pancréatique, lymphome) ou toxiques. Toutefois, d’autres causes doivent être inclues dans le diagnostic différentiel à savoir les atteintes osseuses (fractures, ostéosarcome, rachitisme), un animal en croissance, les tumeurs mammaires (benignes ou malignes), l’administration de mé-dicaments (corticoïdes, phénobarbital, dilantine, primidone, thyroxine) et l’hyperphosphatasémie bénigne familiale du Husky. L’élévation des ALAT est généralement en faveur de lésions cytolytiques hépatiques (dégénératives, métaboliques, anomalies vascu-laires, néoplasiques, inflammatoires, toxiques, traumatiques, nutritionnelles ou héréditaires) et plus rarement a des atteintes musculo-squelettiques. Afin d’explorer l’ictère et l’élévation de l’activité sérique des enzymes hépatiques, une échographie abdominale est réalisée et révèle une hépatomégalie avec un foie hypoéchogène compatible avec des signes d’hépatite accom-pagnée d’un discret épanchement abdominal probablement d’origine inflammatoire.
Paramètres Valeurs Normes usuelles [15]
Globules rouges (M/µL) 4,1 5,5 – 8,5
Hématocrite (%) 34,2 38 – 57
Hémoglobine (g/dL) 11,6 13,2 – 19,3
Globules blancs 21,1 6 – 17
Polynucléaires neutrophiles (K/µL) 17,5 3 – 11,8
Monocytes (K/µL) 1,05 0,1 – 1,3
Tableau 3. Résultats des examens hématologiques de Sacha.
Paramètres Valeurs Normes du laboratoire
GLU (mg/dL) 1,00 0,6 – 1,10
CREA (mg/dL) 5,04 5,5 – 12,5
UREE (g/L) 0,14 0,14 – 0,56
ALB (g/L) 30,45 23 – 39
ALAT (U/L) 134,3 <40
PAL (U/L) 1435,16 <200
Tableau 4. Résultats des examens biochimiques sanguins de Sacha.
L’examen microscopique du frottis sanguin (coloration réactif RAL 555, May-Grünwald Giemsa modifiée) a révélé la présence dans les érythrocytes de micro-organismes piriformes en paires et de grandes tailles (cas de Rocky, Photo 2) ou de petite taille organisée en paire ou en tétrade (cas de Sacha) compatibles avec des inclusions de Babesia spp.
Photo 2. Inclusion intra-érythrocytaire de grande taille en paire compatibles avec des inclusions de Babesia spp. chez Rocky.
Traitement et évolution
Le jour de leur admission, les deux chiens ont reçu une perfusion de Ringer Lactate (5 ml/kg/h), un antivomitif à base de métoclopramide (0,5 mg/kg toutes les 8h d’abord en IV puis en relai PO) et un protecteur hépato-rénal à base de sorbitol, bétaïne, arginine, ornitine et citrulline (3ml en injection sous-cutanée). La perfusion a été poursuivi pendant 3 jours. Une antibiothérapie à base de doxycycline à la dose de 10mg/kg par voie orale pendant 28 jours a été prescrite pour Rocky car la sévérité de la thrombocytopénie peut être due à une co-infection par d’autres maladies transmises par les tiques (Ehrlichia canis, Anaplasma platys notamment).
Le traitement spécifique de la babésiose canine a consisté en l’injection sous-cutanée de di-propionate d’imidocarbe (CARBÉSIA ND) à raison de 5 à 7 mg/kg à deux semaines d’intervalle.
L’état de Rocky s’est nettement amélioré cliniquement avec une bonne reprise de l’activité et de l’alimentation et une normalisation des modifications hématologiques après 15 jours. Mal-heureusement, à l’inverse l’état de Sacha s’est progressivement détérioré durant les 3 semaines de suivi jusqu’à son décès.
Discussion
Les manifestations cliniques de la babésiose sont extrêmement variables dans leur expression, leur durée et leur gravité. La forme classique la plus fréquente est caractérisée par l’apparition aiguë de symptômes généraux incluant abattement, prostration, refus de toute sollicitation, anorexie, fièvre, adénomégalie et syndrome hémolytique (anémie, hémoglobinurie, bilirubinu-rie, ictère) [Bourdoiseau, 2006; Solano-Gallego et al., 2016]. L’évolution vers une anémie sé-vère engageant le pronostic vital est possible [Jacobson and Clark, 1994]. Une deuxième forme, dite compliquée, se caractérise par des atteintes d’un ou plusieurs organe(s) incluant insuffisance rénale aiguë, coagulation intra-vasculaire disséminée (CIVD), hépatopathie, pan-créatite aiguë, anémie hémolytique à médiation immunitaire, syndrome de détresse respiratoire aiguë, troubles neurologiques (démarche ébrieuse, lombalgie et arthralgies, parésie, paralysies, ataxie, convulsions, nystagmus, anisocorie, modifications comportementales, coma), hémo-concentration, état de choc, troubles acido-basiques ou troubles du rythme cardiaque [Jacob-son and Clark, 1994; Dvir et al., 2004; Jacobson, 2006; Matijatko et al., 2010; Defauw et al., 2020]. Les deux organes les plus fréquemment touchés sont le foie et le rein. La mortalité lors de forme compliquée est élevée (entre 53 et 95%) et dépend notamment du type et du nombre d’organes atteints [Matijatko et al., 2010; Solano-Gallego et al., 2016]. Un portage chronique est également rapporté due à l’incapacité du système immunitaire du chien à éliminer l’infection. Cette forme chronique est notamment décrite avec B. vogeli et les petites Babesia, et peut entrainer l’apparition de signes cliniques suite à toute cause induisant une baisse de l’immunité de l’animal (traitement immunosuppresseur, splénectomie, stress post-chirurgical…). Le pronostic de la babésiose dépend donc de la forme clinique, de l’évolution, de la présence de complication ou de maladies intercurrentes mais également de l’espèce de Babesia en cause [Solano-Gallego et al., 2016].
Dans les deux cas décris, aucun n’a présenté la forme hémolytique classique de la babésiose. Sacha a manifesté une atteinte hépato-biliaire et possiblement pancréatique tandis que Rocky a présenté une thrombocytopénie sévère. Il est donc important d’inclure la babésiose canine dans le diagnostic différentiel des atteintes hépatiques, rénales, pancréatiques, nerveuses, res-piratoires et des modifications hématologiques (thrombocytopénie, anémie hémolytique à mé-diation immunitaire, CIVD).
Le diagnostic de la babésiose repose sur l’identification des signes cliniques, des modifications hématologiques et la détection des piroplasmes sur le frottis sanguin. Les principales modifications hématologiques rencontrées lors de babésiose canines sont la l’anémie et la thrombopénie [Birkenheuer, 2012]. L’anémie est généralement macrocytaire, hypochrome et régénérative en cours d’évolution mais peut également être non régénérative notamment en début d’évolution [Birkenheuer, 2012; Solano-Gallego et al., 2016]. La thrombopénie semble plus fréquente lors de babésiose canine que d’ehrlichiose et sa présence doit faire suspecter une infection à Babesia spp. même en absence d’anémie [Carli et al., 2009; Birkenheuer, 2012]. Une étude sur 248 chiens naturellement infectés par des grandes Babesia dénombre 98% de cas présentant une thrombopénie dont 65% modérées (25 000 - 49 000 plaquettes/mm³) et 15 % sévères (< 25 000 plaquettes/mm³) [Zygner et al., 2007]. Les deux chiens décrits dans cet article ont présenté une anémie pour l’un et une thrombocytopénie pour l’autre; mais tous deux ont manifesté des modification du comptage leucocytaire. Contrairement à l’anémie ou la thrombocytopénie, le comptage leucocytaire est modifié de façon inconstante lors de babésiose canine et les anomalies les plus fréquemment rencontrées sont la leucocytose (avec ou sans virage à gauche des polynucléaires neutrophiles), la neutrophilie (comme pour Sacha), la neutropénie, la lymphocytose, l’éosinophilie ou la leucopénie [Birken-heuer, 2012; Solano-Gallego et al., 2016]. Rocky a présenté une discrète lymphopénie associée à une monocytose qui peut être le signe d’un stress avec décharge de cortisol; généralement ces deux anomalies sont également accompagnées d’une légère neutrophile mature.
Les modifications biochimiques quant à elles ne sont pas spécifiques et incluent généralement une hyperglobulinémie, une légère augmentation de l’activité sérique des enzymes hépatiques (ALAT, ASAT, PAL) et plus rarement l’hyperbilirubinémie ou hémoglobinémie. D’autres anomalies moins fréquentes peuvent être détectées telles que l’hypoglycémie, les désordres électrolytiques (hypokaliémie, hyperkaliémie, hyponatrémie, hyperchlorémie, hyperlactatémia, hyperphosphatémie), une baisse des protéines totales, de l’albumine et du ratio albu-mine/globulines, une azotémie (pré-rénale ou rénale), une acidose métabolique et une hyper-triglycéridémie [Birkenheuer, 2012; Solano-Gallego et al., 2016]. Sacha a présenté une forte élévation des PAL et une légère des ALAT tandis que le bilan biochimique de Rocky était parfaitement normal. Une hyperphosphatasémie familiale bénigne a été décrite chez des chiots Husky de Sibérie âgés de 11 à 16 semaines sans aucune autre anomalie détectée à l’examen clinique, radiographique, hématologique, biochimique et hormonologique [Lawler et al., 1996]. Sacha est de la même race que ces chiots mais étant donné son âge et les modification héma-tologiques, l’augmentation des ALAT concomitante à celle des PAL, l’ictère et l’aspect anor-mal du foie à l’échographie, cette hypothèse est très peu probable pour expliquer l’augmentation marquée des PAL chez ce chien. Les deux chiens décrits dans cet article sont de race Husky de Sibérie. Une étude a également constaté que les Husky de Sibérie étaient parmi les races les plus à risque de contracter la babésiose [Mellanby et al., 2011]. De même, plusieurs études ont démontrer l’existence de prédispositions raciales à l’infection par les Ba-besia spp. Ainsi, les lévriers avaient une prévalence plus importante ou un risque plus élevé de contracter l’infection à B. vogeli et B. canis en Floride et Pologne, respectivement [Birkenheu-er, 2012]. En Hongrie, la séroprévalence à B. canis était plus élevée chez le Berger Allemand et le Komondor [Hornok et al., 2006]. Enfin, une prédisposition raciale à l’infection par B. gibsoni et B. rossi chez les chiens de combats (American Pitt Bull Terriers, Staffordshire bull terrier, Rottweilers et Bull Terriers) a été décrite aux USA et en Afrique du Sud, respective-ment [Birkenheuer, 2012].
La parasitémie lors d’infection à Babesia spp. est modérée à élevée avec une infection aiguë mais dans les formes subcliniques ou chroniques elle est faible voire absente [Boozer and Mac-intire, 2003; Schoeman, 2009; Solano-Gallego and Baneth, 2011]. De ce fait, l’observation d’un piroplasme quel que soit sa forme, a une valeur diagnostique mais la non observation de piroplasme sur le frottis ne permet pas d’exclure une piroplasmose. Afin de mieux détecter les piroplasmes lors de l’examen microscopique du frottis sanguin, un enrichissement par centrifugation peut être réalisé [Hugnet et al., 2000]. Le prélèvement de sang capillaire peut également augmenté la sensibilité de détection des inclusions de Babesia spp. sur le frottis sanguin [Boozer and Macintire, 2003; Böhm et al., 2006]. Dans le cas de Rocky, les inclusions de Babesia spp ont été détectées dans un seul globule rouge indiquant une faible parasitémie et la nécessité d’un examen minutieux et méthodique du frottis sanguin. Les inclusions intra-cytoplasmiques de Babesia spp. semblaient être différentes entre les deux chiens, suggérant la présence possible de différentes espèces de Babesia circulant dans la population canine au Maroc. Il est important de signaler qu’aucune étude épidémiologique sur la babésiose canine n’a actuellement été publiée au Maroc.
D’autres tests diagnostics peuvent être utilisés incluant l’analyse sérologique permettant de détecter les anticorps anti-Babesia spp. Les méthodes les plus fréquemment utilisées sont l’immunofluorescence indirecte (IFI) et l’enzyme-linked immunosorbant assay (ELISA) [Homer et al., 2000; Solano-Gallego et al., 2016]. Les tests sérologiques restent sujets aux ré-actions antigéniques croisées dues aux antigènes communs entre les différentes espèces de piroplasmes et un titre positif indique une exposition préalable mais ne permet pas de confir-mer une infection active surtout en zone d’endémie [Schoeman, 2009; Homer et al., 2000; Solano-Gallego et al., 2016]. De plus, en début d’infection, les tests sérologiques peuvent se révéler négatifs à cause du délai nécessaire à l’organise de l’animal pour produire les anticorps. Par conséquent, l’établissement d’un diagnostic sérologique et la confirmation d’une infection active doit se baser sur la cinétique du titre d’anticorps entre la phase aiguë et la phase de con-valescence (4-8 semaines d’intervalle) ou la mise en évidence la séroconversion [Solano-Gallego et al., 2016]. Finalement, la technique de choix pour détecter le parasite est l’amplification de son ADN par la réaction de polymérase en chaîne (PCR). En effet, la PCR est actuellement l’examen complémentaire le plus sensible et le plus spécifique puisqu’elle permet une identification de l'espèce causale infectant le chien, contrairement aux deux autres méthodes, et présente donc un intérêt épidémiologique. Toutefois, des résultats faussement négatifs sont décrits notamment lors d’infection chronique, notamment par B. gibsoni, due à l’absence de parasitémie. Dans ce cas, le recours au diagnostic sérologique ou la réalisation d’une PCR sur prélèvement splénique sont une alternative pour le diagnostic [Solano-Gallego et al., 2016].
La prise en charge thérapeutique de la babésiose canine nécessite un traitement spécifique et un traitement symptomatique de soutient (transfusion, perfusion, glucocorticoïdes…) dépen-dant des signes cliniques et de leur sévérité ainsi que des différents organes atteints [Jacobson and Swan, 1995]. Différentes molécules ou associations de molécules ont été utilisées de fa-çon efficace dans le traitement des babésioses canines (Irwin, 2009, Solano-Gallego and Baneth, 2011; Baneth, 2018). Au Maroc, la seule molécule babésicide disponible est l’imidocarbe dipropionate qui doit être administrée à la dose de 5-6,6 mg/kg en intramuscu-laire (IM) ou sous-cutané (SC) répétée à 2 semaines d’intervalles [Birkenheuer, 2012; Solano-Gallego et al., 2016; Baneth, 2018]. L’injection sous-cutanée est fréquemment à l’origine de manifestations douloureuses locales. D’autres effets secondaires associés à l’effet choliner-gique de l’imidocarbe incluant l’hypersalisation, des écoulements naseaux et des vomisse-ments ont été rapportés et peuvent être limités par l’injection préalable d’atropine à la dose de 0,05mg/kg. D’autres effets secondaires moins fréquents sont également décris tels que l’halètement, l’agitation, des diarrhées, une nécrose hépatique ou tubulaire rénale et des in-flammations ou ulcérations au site d’injection qui guérissent en quelques jours à quelques se-maines [Baneth, 2018]. La majorité des chiens infectés par des larges Babesia présentent une amélioration clinique 1 à 7 jours après traitement, même si certains peuvent avoir une conva-lescence plus longue allant jusqu’à 2 semaines [Solano-Gallego et al., 2016]. L’imidocarbe dipropionate est efficace contre les grandes Babesia mais pas contre les petites Babesia. Le traitement de ces dernières semble poser plus de problème et nécessite l’utilisation d’association de molécules [Solano-Gallego et al., 2016; Baneth, 2018]. En effet, le traitement de la babésiose à B. gibsoni repose sur l’association atovaquone (13,3 mg/kg/8h PO) et azi-thromycine (10 mg/kg/24h PO) pendant 10 jours puis la combination de clindamycine/métronidazole/doxycycline clindamycin/imidocarb/diminazene en cas d’échec de la première association [Birkenheuer et al., 2004; Suzuki et al., 2007; Sakuma et al., 2009; Lin et al., 2012; Checa et al., 2017; Solano-Gallego et al., 2016; Baneth, 2018]. L’association atovaquone et azithromycine est également efficace dans le traitement des infections à B. ca-nis [Birkenheuer, 2012]. L’azithromycine associée à l’atovaquone ou à la buparvaquone (5mg/kg/48h IM) semble présenter la meilleure efficacité dans le traitement de l’infection à B. microti-like sans pour autant permettre l’élimination complète du parasite [Solano-Gallego et al., 2016; Checa et al., 2017]. Les petites Babesia sont fréquemment non éliminées malgré le traitement spécifique et l’animal reste chroniquement infecté pouvant transmettre les parasites et faire des rechutes cliniques. De ce fait, les chiens doivent être suivi afin de détecter une persistance d’infection par PCR ou évaluation du frottis sanguin, le cas échéant [Solano-Gallego et al., 2016; Baneth, 2018]. L’un des deux chiens (Sasha) décrit dans cet article, sem-blait avoir des inclusions de plus petite taille. Ce chien a présenté une atteinte hépatite ou post-hépatique sévère et n’a pas répondu au traitement par l’imidocarbe dipropionate. Il est possible que l’absence de réponse soit due à une évolution sévère de la maladie avec atteinte organique avancée ayant induit le décès. Toutefois, il est également possible que l’échec de traitement spécifique soit due à une infection par des petites Babesia. Ce cas met ainsi en relief l’importance de l’identification des espèces de Babesia circulant chez le chien au Maroc afin de mieux adapter le protocole thérapeutique.
La prévention de l’infection des chiens par les piroplasmes repose sur la mise en place de mé-thode de lutte contre les tiques vectrices notamment par l’utilisation de substances acaricides ou répulsives sous forme de spot-on, collier, spray ou comprimés [Beugnet et al., 2014; Taenz-ler et al., 2015; Blair et al., 2016; Cavalleri et al., 2017], le retrait des tiques attachées au chien à l’aide de dispositifs adaptés, la limitation de fréquentation des zones boisées fortement in-festés ainsi que le traitement acaricide des niches et chenils. Au Maroc, différentes spéciali-tées vétérinaires ayant un effect acaricides avec une rémanence variable sont disponibles no-tamment l’amitraze, le fipronyl, la delthamétrine et l’association afaxolaner et milbémicine oxime.
Conclusion
La prévalence de la babésiose canine et le nombre d’espèces de Babesia présentes au Maroc sont actuellement inconnues. Ces données sont nécessaires afin de sensibiliser les vétérinaires praticiens, d’adapter le protocole thérapeutique et d’éclairer le pronostic de cette pathologie qui peut être grave et entraîner la mort de l’animal. Bien que les Babesia infectant le chien ne soient pas zoonotiques, les chiens sont une sources de tiques infectées pouvant de ce fait être transportées au contact de l’Homme et lui transmettre de nombreuse maladies. L’éducation des propriétaires face à la présence des tiques et à leur rôle comme vecteur de pathogènes ainsi que leur sensibilisation à l’utilisation régulière et adéquate d’antiparasitaires externes est essentielle afin de protéger l’animal et son entourage contre les maladies transmises par les tiques.
Références
1. Uilenberg G. (2006). Babesia—a historical overview. Vet. Parasitol. 138: 3-10. https://www.ncbi.nlm.nih.gov/pubmed/16513280
2. Irwin PJ. (2009). Canine babesiosis: from molecular taxonomy to control. Parasit. Vec-tors. 2 (Suppl 1): 4.
3. Solano-Gallego L, Baneth G. (2011). Babesiosis in dogs and cats--expanding parasito-logical and clinical spectra. Vet. Parasitol. 181: 48-60.
4. Schoeman JP. (2009). Canine babesiosis. Onderstepoort. J. Vet. Res. 76: 59-66.
5. Kjemtrup AM, Kocan AA, Whitworth L, Meinkoth J, Birkenheuer AJ, Cummings J, Boudreaux MK, Stockham SL, Irizarry-Rovira A, Conrad PA. (2000). There are at least three genetically distinct small piroplasms from dogs. Int. J. Parasitol. 30: 1501-1505.
6. Boozer AL, Macintire DK. (2003). Canine babesiosis. Vet. Clin. North. Am. Small. Anim. Pract. 33: 885-904.
7. Zahler M, Schein E, Rinder H, Gothe R. (1998). Characteristic genotypes discriminate between Babesia canis isolates of differing vector specificity and pathogenicity to dogs. Parasitol. Res. 84: 544-548.
8. Carret C, Walas F, Carcy B, Grande N, Précigout E, Moubri K, Schetters TP, Goren-flot A. (1999). Babesia canis canis, Babesia canis vogeli, Babesia canis rossi: differen-tiation of the three subspecies by a restriction fragment length polymorphism analysis on amplified small subunit ribosomal RNA genes. J. Eukaryot. Microbiol. 46: 298-303.
9. Solano-Gallego L, Sainz Á, Roura X, Estrada-Peña A, Miró G. (2016). A review of ca-nine babesiosis: the European perspective. Parasit. Vectors. 9: 336.
10. Baneth G. (2018). Antiprotozoal treatment of canine babesiosis. Vet. Parasitol. 254: 58-63.
11. Bourdoiseau G. (2006). Canine babesiosis in France. Vet. Parasitol. 138: 118-125.
12. M'ghirbi Y, Bouattour A. (2008). Detection and molecular characterization of Babesia canis vogeli from naturally infected dogs and Rhipicephalus sanguineus ticks in Tuni-sia. Vet. Parasitol. 152: 1-7.
13. Salem NY, Farag HS. (2014). Clinical, hematologic, and molecular findings in naturally occurring Babesia canis vogeli in Egyptian dogs. Vet. Med. Int. 2014: 270345.
14. Rjeibi MR, Amairia S, Rouatbi M, Ben Salem F, Mabrouk M, Gharbi M. (2016). Mole-cular prevalence and genetic characterization of piroplasms in dogs from Tunisia. Para-sitol. 143: 1622-1628.
15. Uilenberg G, Franssen FF, Perié NM, Spanjer AA. (1989). Three groups of Babesia ca-nis distinguished and a proposal for nomenclature. Vet. Q. 11: 33-40.
16. Matjila PT, Penzhorn BL, Bekker CP, Nijhof AM, Jongejan F. (2004). Confirmation of occurrence of Babesia canis vogeli in domestic dogs in South Africa. Vet. Parasitol. 122: 119-125.
17. Oyamada M, Davoust B, Boni M, Dereure J, Bucheton B, Hammad A, Itamoto K, Okuda M, Inokuma H. (2005). Detection of Babesia canis rossi, B. canis vogeli, and Hepatozoon canis in dogs in a village of eastern Sudan by using a screening PCR and sequencing methodologies. Clin. Diagn. Lab. Immunol. 12: 1343-1346.
18. Sasaki M, Omobowale O, Tozuka M, Ohta K, Matsuu A, Nottidge HO, Hirata H, Ika-dai H, Oyamada T. (2007). Molecular survey of Babesia canis in dogs in Nigeria. J. Vet. Med. Sci. 69: 1191-1193.
19. Cardoso L, Oliveira AC, Granada S, Nachum-Biala Y, Gilad M, Lopes AP, Sousa SR, Vilhena H, Baneth G. (2016). Molecular investigation of tick-borne pathogens in dogs from Luanda, Angola. Parasit. Vectors. 9: 252.
20. Lobetti RG. (1998). Canine babesiosis. Comp. Cont. Educ. Pract. Vet. 20: 418-430.
21. Jacobson LS, Clark IA. (1994). The pathophysiology of canine babesiosis: new ap-proaches to an old puzzle. J. S. Afr. Vet. Assoc. 65: 134-145.
22. Matijatko V, Kis I, Torti M, Brkljacić M, Rafaj RB, Zvorc Z, Mrljak V. (2010). Sys-temic inflammatory response syndrome and multiple organ dysfunction syndrome in canine babesiosis. Vet. Archiv. 80: 611-626.
23. Dvir E, Lobetti RG, Jacobson LS, Pearson J, Becker PJ. (2004). Electrocardiographic changes and cardiac pathology in canine babesiosis. J. Vet. Cardiol. 6: 15-23.
24. Jacobson LS. (2006). The South African form of severe and complicated canine babesiosis: clinical advances 1994-2004. Vet. Parasitol. 138: 126-139.
25. Defauw P, Schoeman JP, Leisewitz AL, Goddard A, Duchateau L, Aresu L, Meyer E, Daminet S. (2020). Evaluation of acute kidney injury in dogs with complicated or un-complicated Babesia rossi infection. Ticks. Tick. Borne. Dis. 11: 101406.
26. Birkenheuer AJ. (2012). Babesiosis. In: Greene GE, ed. Infectious diseases of the dog and the cat, fourth edition, Elsevier Sauders; pp. 771-784.
27. Carli E, Tasca S, Trotta M, Furlanello T, Caldin M, Solano-Gallego L. (2009). Detec-tion of erythrocyte binding IgM and IgG by flow cytometry in sick dogs with Babesia canis canis or Babesia canis vogeli infection. Vet. Parasitol. 162: 51-57.
28. Zygner W, Gójska O, Rapacka G, Jaros D, Wedrychowicz H. (2007). Hematological changes during the course of canine babesiosis caused by large Babesia in domestic dogs in Warsaw (Poland). Vet. Parasitol. 145: 146-151.
29. Lawler DF, Keltner DG, Hoffman WE, Nachreiner RF, Hegstad RL, Herndon PA, Fischer BJ. (1996). Benign familial hyperphosphatasemia in Siberian huskies. Am. J. Vet. Res. 57: 612-617.
30. Mellanby RG, Handel IG, Clements DN, de C. Bronsvoort BM, Lengeling A, Schoe-man JP. (2011). Breed and Sex Risk Factors for Canine Babesiosis in South Africa. J. Vet. Intern. Med. 25: 1186-1189.
31. Hornok S, Edelhofer R, Farkas R. (2006). Seroprevalence of canine babesiosis in Hun-gary suggesting breed predisposition. Parasitol. Res. 99: 638-642.
32. Hugnet C, Bruchon-Hugnet C, Bourdoiseau G. (2000). Amélioration du diagnostic de laboratoire de la babésiose canine : intérêt d’une technique d’enrichissement par cen-trifugation. Prat. Méd. Chir. Anim. Comp. 35: 59-62.
33. Böhm M, Leisewitz AL, Thompson PN, Schoeman JP. (2006). Capillary and venous Babesia canis rossi parasitaemias and their association with outcome of infection and circulatory compromise. Vet. Parasitol. 141: 18-29.
34. Homer MJ, Aguilar Delfin I, Teleford III SR, Krause PJ, Persing DH. (2000). Babesio-sis. Clin. Microbiol. Rev. 13: 451-469.
35. Birkenheuer AJ, Levy MG, Breitschwerdt EB. (2004). Efficacy of combined ato-vaquone and azithromycin for therapy of chronic Babesia gibsoni (Asian genotype) in-fections in dogs. J. Vet. Intern. Med. 18: 494-498.
36. Suzuki K, Wakabayashi H, Takahashi M, Fukushima K, Yabuki A, Endo Y. (2007). A possible treatment strategy and clinical factors to estimate the treatment response in Babesia gibsoni infection. J. Vet. Med. Sci. 69: 563-568.
37. Sakuma M, Setoguchi A, Endo Y. (2009). Possible emergence of drug-resistant vari-ants of Babesia gibsoni in clinical cases treated with atovaquone and azithromycin. J. Vet. Intern. Med. 23: 493-498.
38. Lin EC, Chueh LL, Lin CN, Hsieh LE, Su BL. (2012). The therapeutic efficacy of two antibabesial strategies against Babesia gibsoni. Vet. Parasitol. 186, 159-164.
39. Checa R, Montoya A, Ortega N, González-Fraga JL, Bartolomé A, Gálvez R, Marino V, Miró G. (2017). Efficacy, safety and tolerance of imidocarb dipropionate versus atovaquone or buparvaquone plus azithromycin used to treat sick dogs naturally infect-ed with the Babesia microti-like piroplasm. Parasit. Vectors. 10: 145.
40. Beugnet F, Halos L, Larsen D, Labuschagné M, Erasmus H, Fourie J. (2014). The abil-ity of an oral formulation of afoxolaner to block the transmission of Babesia canis by Dermacentor reticulatus ticks to dogs. Parasit. Vectors. 7: 283.
41. Taenzler J, Liebenberg J, Roepke RKA, Heckeroth AR. (2015). Prevention of trans-mission of Babesia canis by Dermacentor reticulatus ticks to dogs treated orally with fluralaner chewable tablets (BravectoTM). Parasit. Vectors. 2015; 8: 305.
42. Blair J, Fourie JJ, Varloud M, Horak IG. (2016). Efficacy and speed of kill of a topical-ly applied formulation of dinotefuran- permethrin-pyriproxyfen against weekly tick in-festations with Rhipicephalus sanguineus (sensu lato) on dogs. Parasit. Vectors. 9: 283.
43. Cavalleri D , Murphy M , Seewald W , Drake J , Nanchen S. (2017). Two randomized, controlled studies to assess the efficacy and safety of lotilaner (CredelioTM) in pre-venting Dermacentor reticulatus transmission of Babesia canis to dogs. Parasit. Vec-tors. 10: 520.
Publié-e
Comment citer
Numéro
Rubrique
Licence

Revue Marocaine des Sciences Agronomiques et Vétérinaires est mis à disposition selon les termes de la licence Creative Commons Attribution - Pas d’Utilisation Commerciale - Partage dans les Mêmes Conditions 4.0 International.
Fondé(e) sur une œuvre à www.agrimaroc.org.
Les autorisations au-delà du champ de cette licence peuvent être obtenues à www.agrimaroc.org.

