Diagnostic différentiel entre la neuropathie périphérique et la maladie de Marek chez la poulette pondeuse: Revue bibliographique et suspicion d’un premier cas au Maroc
Résumé
Cette étude rapporte pour la première fois une suspicion de la neuropathie périphérique ressemblant cliniquement à la maladie de Marek sur 3 cas de terrain de poules pondeuses au Maroc. Les symptômes se résument à un syndrome neurologique chez les poules de 5 à 12 semaines d’âge et se manifestant par la position du « grand écart » (un membre se porte vers l’avant tandis que l’autre se porte vers l’arrière) et un taux de mortalité de 1%. L’autopsie a révélé un épaississement des nerfs périphériques et l’absence de tumeurs sur les autres organes. L’étude histologique des lésions nerveuses a mis en évidence une infiltration lymphoïde avec de l’œdème et de la démyélinisation. La maladie de Marek a été écartée par la PCR en temps réel dans la mesure où aucun des tissus évalués ne présentait une charge élevée d’ADN du virus de la maladie de Marek. En ce basant sur ces résultats, la neuropathie périphérique peut être différenciée de la maladie de Marek. En effet, la littérature rapporte que les deux maladies peuvent être confondues de part les signes cliniques et les lésions d’épaississement des nerfs périphériques. Les signes cliniques de la neuropathie périphérique sont observés dès 5 semaines d’âge avec des lésions d’infiltration de type B (inflammatoires) et l’absence de tumeurs viscérales, tandis que ceux de la maladie de Marek ne se manifestent qu’après 8-9 semaines d’âge avec des lésions d’infiltration de type A (tumorales) et présence de tumeurs viscérales.
Mots clés: Neuropathie périphérique, Maladie de Marek, diagnostic différentiel, PCR en temps réel
Téléchargements
Introduction
La maladie de Marek est une maladie lymphoproliférative causée par un alpha-herpesvirus du genre Mardivirus isolé pour la première fois en 1968 (Churchill ,1968). Elle a été décrite pour la première fois par Joseph Marek en 1907 et se manifeste par le développement de tumeurs et l’épaississement des nerfs périphériques et se présente comme la principale cause de paralysies des volailles. Cependant, l’épaississement des nerfs périphériques n’est pas une lésion pathognomonique de la maladie de Marek car elle peut se manifester dans d’autres maladies. En effet, le syndrome de neuropathie périphérique décrit initialement sur des poules SPF (Biggs et al., 1982), puis ultérieurement sur des volailles destinées à la consommation (Julian, 1992; Witter et Bacon, 1995; Bacon et al., 2001) est caractérisé par des lésions nerveuses macroscopiquement et microscopiquement indifférenciables de celles causées par le virus de la maladie de Marek (MDV). Il est donc évident que des erreurs de diagnostic existent entre ces deux maladies.
La neuropathie périphérique est une maladie auto-immune qui atteint les poulets entre 6 et 9 semaines d’âge (Bacon et al., 2001). Plusieurs facteurs peuvent être à l’origine de cette maladie notamment l’utilisation de vaccins multivalents contre la maladie de Marek, Gumboro, Newcastle et la bronchite infectieuse (Bacon et al, 2001) ou encore une infection par Campylobacter Jejuni (Bader et al., 2010).
Le diagnostic de la neuropathie périphérique peut être établi si les poulets en question sont à 6-9 semaines d’âge avec des signes cliniques neurologiques, des lésions macroscopiques d’épaississement des nerfs périphériques et absence de tumeurs au niveau des autres organes (Bacon et al., 2001). L’histopathologie des nerfs périphériques peut aider à confirmer le diagnostic. Les lésions observées dans ce cas sont de l’œdème et une infiltration des cellules plasmatiques (Payne et Biggs, 1967). Cependant, ces lésions sont aussi observables après une infection par le MDV. Par conséquent, si l’historique et l’âge des poulets n’est pas pris en considération, plusieurs cas de neuropathie périphérique passent inaperçus et sont diagnostiqués comme des cas de la maladie de Marek sur la base des lésions histologiques. Il est donc pertinent d’utiliser des techniques complémentaires pour établir le diagnostic différentiel entre la neuropathie périphérique et la maladie de Marek. Dans ce cadre, l’évaluation de la charge en MDV sur les tumeurs, les follicules plumeux, la rate ou le sang en utilisant la PCR en temps réel s’est avéré être un outil de diagnostic de certitude (Gimeno et al., 2005; Gimeno et al., 2008; Cortes et al., 2011).
Le mauvais diagnostic de la neuropathie périphérique comme étant la maladie de Marek entraîne de lourdes pertes économiques. En effet, un mauvais diagnostic pousse à renforcer la vaccination en augmentant la dose du vaccin ou la mise en place d’un nouveau protocole de vaccination. Au lieu de résoudre le problème, ce renforcement pourrait l’exacerber (Bacon et al., 2001). Par conséquent, un bon diagnostic de la neuropathie périphérique peut minimiser ces pertes économiques.
C’est dans cette optique que ce travail rapporte pour la première fois au Maroc, le diagnostic différentiel de la neuropathie périphérique ressemblant cliniquement à la maladie de Marek sur 3 cas de terrain de poules pondeuses.
Matériel et méthodes
Anamnèse et commémoratifs
L’étude concerne trois cas cliniques d’atteintes neurologiques survenues sur des poulettes pondeuses au Maroc (Casablanca, El Jadida) en 2019. Tous ces cas se sont produits sur des élevages commerciaux de poulettes pondeuses brunes élevées soit en sol soit en cage. Ces élevages ont été vaccinés contre la maladie de Marek en utilisant la souche CVI988 (Rispens) ou une combinaison avec la souche HVT. Les symptômes se résument à un syndrome neurologique chez les poules de 5 à 12 semaines d’âge et se manifestant par la position du «grand écart» (un membre se porte vers l’avant tandis que l’autre se porte vers l’arrière) et un taux de mortalité de 1%.
Autopsie et collecte des échantillons
Les animaux soumis à l’étude ont été correctement euthanasiés. A l’autopsie, on a cherché à mettre en évidence des lésions macroscopiques au niveau des nerfs périphériques, du cerveau, des organes lymphoïde (rate, bourse de Fabricius et thymus), des organes viscéraux et de la peau. On a aussi évalué l’état des muscles et des articulations pour écarter une éventuelle atteinte musculo-squelettique. Ensuite, on a prélevé les organes (rate, foie, nerfs périphériques et follicules plumeux) afin de réaliser l’étude histopathologique. Cette dernière a été réalisée au département d’anatomie pathologique de l’IAV Hassan 2.
Histopathologie
Les échantillons ont été fixés dans un bain de formol à 10% pendant 48 H, déshydratés successivement dans des bains d’alcool (70°, 95°, 100°) et de toluène. Les échantillons sont ensuite inclus dans des blocs de paraffine puis coupés à l’aide d’un microtome qui permet d’obtenir des tranches de sections de 2 à 5µm. Ces sections sont alors montées sur des lames et colorées avec de l’Hématoxyline-Eosine (H et E).
Analyse moléculaire
L’ADN a été extrait à partir des follicules plumeux des animaux autopsiés. Nous avons utilisé le kit d’extraction «Isolate II Genomic DNA Kit, Bioline». Les amorces utilisées sont spécifiques pour le gène UL19 (MDV031) codant pour une protéine structurale de la nucléocapside du virus de la maladie de Marek, la VP5. Il s’agit du couple d’amorces 432 et 433 qui vont permettre l’amplification d’un fragment d’ADN de 283 bp (Figueroa et al., 2016).. La réaction PCR a été réalisée à l’aide d’un thermocycleur AriaMx® G8830A. Dans un mélange de 50 µl, nous avons 25 µl du mélange de PCR prêt à l’emploi «DreamTaq Green PCR Master Mix, Invitrigène», 0,4 µM de chaque amorce, 0,1 µg d’extrait d’ADN. La réaction a été cyclée 40 fois selon le programme suivant: 95°C pour la dénaturation pendant 30 s, 60°C pendant 30 secondes pour l’hybridation et 72°C pendant une minute pour l’élongation au bout de laquelle on obtient une fluorescence. Ensuite, le paramètre Ct a été calculé pour chaque réaction PCR. Le cycle seuil, ou «threshold cycle» (Ct) d’un puits correspond, pour chaque fluorescence détectée, à l’abscisse du point d’intersection entre la ligne seuil et la courbe d’amplification. C’est le nombre de cycles nécessaires pour que la fluorescence dépasse le seuil fixé.
Résultats
Autopsie
La principale lésion macroscopique observée sur les trois cas est l’épaississement des nerfs périphériques plus précisément au niveau du plexus sciatique où cette hypertrophie peut être unilatérale ou bilatérale. En revanche, aucune lésion tumorale n’a été observée au niveau des autres organes.

Histopathologie
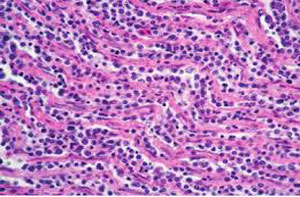
L’étude hitopathologique a révélé des lésions principalement au niveau des nerfs périphériques. Sur tous les cas étudiés, on a mis en évidence une infiltration lymphoïde avec de l’œdème et de la démyélinisation au niveau de ces nerfs. Cependant, de légères lésions tumorales localisées ont été observées sur le troisième cas au niveau du cerveau, du foie, du proventricule et des reins et ceci trois semaines après le début des symptômes.

PCR en temps réel
La charge du virus de la maladie de Marek a été évaluée à partir des follicules plumeux des trois cas soumis à l’étude. Ainsi, l’infection par le virus de la maladie de Marek a été écartée dans la mesure où aucun des tissus n’a révélé une charge élevée de l’ADN du MDV oncogène compatible avec des tissus supposés être en phase latente de l’infection. Les valeurs de Ct pour les trois cas ont été respectivement 35,3; 37,4 et 36,7 (Figure 3).

Discussion
Dans cet article, nous avons décrit trois cas d’atteintes neurologiques qui ont apparus au Maroc en 2019. En effet, des paralysies se sont manifestées chez des poulettes pondeuses de 5 à 12 semaines d’âge associées à un épaississement des nerfs périphériques en absence de lésions au niveau d’autres organes. Ainsi, sur la base de l’historique, de l’étude histopathologique et des résultats de la PCR en temps réel, nous avons émis le diagnostic de la neuropathie périphérique.
Sur le terrain, la maladie de Marek peut être directement sur la base des signes cliniques et des résultats d’autopsie montrant un épaississement des nerfs périphériques associé à la présence de tumeurs. Cependant, si les lésions macroscopiques se limitent à l’épaississement des nerfs périphériques, la maladie de Marek doit être obligatoirement différenciée de la neuropathie périphérique. Les lésions nerveuses induites par le MDV ont été classifiées en lésions de type A, type B et type C (Payne et Biggs, 1967). Les lésions de type A sont caractérisées par une infiltration néoplasique des lymphocytes au niveau des nerfs. Les lésions de type B sont des lésions inflammatoires similaires à celles observées dans les cas de neuropathie périphérique. Les lésions de type C sont des lésions inflammatoires qui touchent quelques proportions de nerfs sous forme d’infiltrats localisés. Ainsi, l’établissement d’un diagnostic de la maladie de Marek seulement sur la base des signes cliniques et des lésions macroscopiques peut engendrer des erreurs dans la mesure où l’hypothèse de la neuropathie périphérique sera négligée.
L’incidence de la neuropathie périphérique n’est pas connue et elle probablement plus élevée que prévu en raison de la confusion avec la maladie de Marek. On peut donc penser que d’autres cas de neuropathie périphérique ont eu lieu dans d’autres régions du Maroc mais ont été diagnostiqués comme étant une infection par le virus de la maladie de Marek. Ces erreurs de diagnostic peuvent causer des pertes économiques car la stratégie menée dans ce cas sera le renforcement de la vaccination contre la maladie de Marek en augmentant la dose vaccinale, changer la souche ou essayer d’autres protocoles. Dans tous les cas, au lieu de résoudre le problème, ce renforcement pourrait l’exacerber. Il en résulte qu’un bon diagnostic de la neuropathie périphérique peut minimiser ces dégâts.
Les critères de diagnostic de la neuropathie périphérique ont été établis par Bacon et al., (2001). Ces critères incluent l’âge d’apparition des signes cliniques (5 à 12 semaines), les trouvailles de l’autopsie (épaississement des nerfs périphériques en absence des lésions tumorales) et de l’étude histopathologique mettant en évidence des lésions d’infiltration plasmocytaires associées à l’œdème et la démyélinisation. Les 3 cas que nous décrivons dans cet article sont en cohérence avec ces critères de diagnostic de la neuropathie périphérique. Les paralysies sont apparus dans l’intervalle de 7 à 10 semaines d’âge, seul un épaississement des nerfs périphériques a été observé à l’autopsie. Ces nerfs ont montré une légère infiltration plasmocytaire associée à de la démyélinisation (à l’exception du troisième cas où on a observé de légères lésions tumorales localisées au niveau du cerveau et de certains organes viscéraux). Dans cette étude, le diagnostic de la neuropathie périphérique a été confirmé en écartant la maladie de Marek en se basant les résultats de la PCR en temps réel.
Le syndrome de neuropathie périphérique ressemble à la maladie de Marek de part les symptômes cliniques et des lésions macroscopiques et microscopiques. Les paralysies associées à une neuropathie périphérique peuvent être observées dès 5 semaines d’âge tandis que celles associées à la maladie de Marek ne peuvent se manifester qu’après 8-9 semaines d’âge. L’autopsie des cas de neuropathie périphérique met en évidence un épaississement des nerfs périphériques en absence de tumeurs au niveau des autres organes. L’étude histologique des nerfs périphériques révèle une infiltration lymphocytaire ou plasmocytaire avec de l’œdème et de la démyélinisation. Cependant, ce type de lésions peut aussi être observé après une infection par le MDV. Il est donc normal d’avoir des erreurs de diagnostic si on se base seulement sur les résultats de l’étude histopathogique car même des pathologistes expérimentés peuvent confondre entre des lésions de type B (inflammatoires) induites par le MDV et celles qui ont pour origine une neuropathie périphérique. La maladie de Marek doit dans ce cas être écartée par l’utilisation de la PCR en temps réel pour mesurer la charge en ADN oncogène du virus MDV au niveau des tissus. Cette technique s’avère être très utile car elle permet la différentiation entre les tissus en phase d’infection latente par le MDV et les tissus avec des tumeurs causées par ce dernier (Gimeno et Wakenell, 2016; Gimeno, et al., 2005a; Witter, et al., 2010). Dans cette étude, la maladie de Marek a été écartée pour les deux premiers cas et grâce à la technique de PCR en temps réel, le diagnostic de la neuropathie périphérique pour ces cas a été confirmé.
Conclusion
En conclusion, la neuropathie périphérique demeure un problème dans le terrain à cause des erreurs de diagnostic avec la maladie de Marek vu la similarité sur le plan clinique et lésionnel entre les deux maladies. Comme on l’a montré dans cette étude, la PCR en temps réel peut être utilisée pour établir un diagnostic de certitude. Par conséquent, tout cas d’atteinte neurologique sur de jeunes poulets avec un épaississement des nerfs périphériques et l’absence de tumeurs au niveau des autres organes doit être plus étudié pour confirmer ou écarter le diagnostic de la maladie de Marek.
Références
Bacon L.D., Witter R.L., Silva R.F. (2001). Characterization and experimental reproduction of peripheral neuropathy in White Leghorn chickens. Avian Pathology, 30: 487-499.
Bader, S.R., Kothlow, S., Trapp, S., Schwarz, S.C., Philipp, H.C., Weigend, S., et al. (2010). Acute paretic syndrome in juvenile White Leghorn chickens resembles late stages of acute inflammatory demyelinating polyneuropathies in humans. J. Neuroinflammation, 7: 7.
Biggs P.M, Shilleto R.F.W., Lawn A.M., Cooper D.M. (1982). Idiopathic polyneuritis in SPF chickens. Avian Pathology, 11: 163-178.
Churchill, A.E. (1968). Herpes-type virus isolated in cell culture from tumors of chickens with Marek’s disease. I. Studies in cell culture. J. Natl. Cancer Inst., 41: 939-950.
Cortes, A.L., Montiel, E.R., Lemiere, S., Gimeno, I.M. (2011). Comparison of blood and feather pulp samples for the diagnosis of Marek’s disease and for monitoring Marek’s Disease vaccination by real time PCR. Avian Diseases, 55: 302-310.
Figueroa T., Boumart I., Coupeau D., Rasschaert D. (2016). Hyperediting by ADAR1 of a new herpesvirus lncRNA during the lytic phase of the oncogenic Marek’s disease virus. Journal of General Virology, 97: 2973–2988.
Gall S., Kőrösi, L., Cortes A. L., Delvecchio A., Prandini F., Mitsch P., Gimeno I. M. (2018). Use of real-time PCR to rule out Marek’s disease in the diagnosis of peripheral neuropathy. Avian Pathology, 47: 427-433.
Gimeno, I.M., Witter, R.L., Fadly, A.M., Silva, R.F. (2005a). Novel criteria for the diagnosis of Marek’s disease virus-induced lymphomas. Avian Pathology, 34: 332- 340.
Gall, S., Kőrösi, L., Cortes, A. L., Delvecchio, A., Prandini, F., Mitsch, P., Gimeno, I. M. (2018). Use of real-time PCR to rule out Marek’s disease in the diagnosis of peripheral neuropathy. Avian Pathology, 47:427–433.
Gimeno, I.M., Witter, R.L., Hunt, H.D., Reddy, S.M., Lee, L.F., Silva, R.F. (2005b). The pp 38 gene of Marek’s disease virus (MDV) is necessary for cytolytic infection of B cells and maintenance of the transformed state but not for cytolytic infection of the feather follicle epithelium and horizontal spread of MDV. J. Virol., 79:4545-4549.
Gimeno, I.M., Cortes, A.L., Silva, R.F. (2008). Load of Challenge Marek’s Disease Virus DNA in Blood as a Criterion for Early Diagnosis of Marek’s Disease Tumors. Avian Diseases, 52: 203-208.
Gimeno, I.M., Wakenell, P.S. (2016). Marek’s disease. In S.M. Williams, L. DufourZavala, M.W. Jackwood, M.D. Lee, B. Lupiani, W.M. Reed (Eds.), A Laboratory Manual for the Isolation, Identification and Characterization of Avian Pathogens pp. 249-258). Jacksonville, FL: American Association of Avian Pathologists.
Julian R.J. (1992). Peripheral neuropathy causing «range paralysis» in Leghorn pullets. Proceeding of the 129th Annual Meeting American Veterinary Medical Association, Boston, p.130.
Payne L.N., Biggs P.M (1967). Studies on Marek’s disease. II. Pathogenisis. Journal of the National Cancer Institute, 39: 281-302.
Witter R.L., Bacon L.D. (1995). A naturally occuring neuropathy of chickens not associated with Marek’s disease. Proceeding of the 132th Annual Meeting American Veterinary Medical Association, Pittsburgh, p. 140.
Witter, R.L., Gimeno, I.M., Pandiri, A.K., Fadly, A.M. (2010). Tumor Diagnosis Manual: The Differential Diagnosis of Lymphoid and Myeloid Tumors in the Chicken. Jacksonville, Florida The American Association of Avian Pathologists.
Publié-e
Comment citer
Numéro
Rubrique
Licence

Revue Marocaine des Sciences Agronomiques et Vétérinaires est mis à disposition selon les termes de la licence Creative Commons Attribution - Pas d’Utilisation Commerciale - Partage dans les Mêmes Conditions 4.0 International.
Fondé(e) sur une œuvre à www.agrimaroc.org.
Les autorisations au-delà du champ de cette licence peuvent être obtenues à www.agrimaroc.org.

