Parasites intestinaux de la grenouille comestible Hoplobatrachus occipitalis (Günther 1858) au Bénin
Résumé
Un inventaire des parasites digestifs de la grenouille comestible Hoplobatrachus occipitalis a été réalisé au Bénin. Au total, 135 spécimens ont été pêchés dans les bassins hydrographiques des fleuves Mono, Ouémé et Niger, et examinés au laboratoire. Les résultats montrent que 78,5% des sujets ont au moins un œuf par gramme de fèces. Les pourcentages d’individus infestés sont de 91,1%, 77,8% et 66,7%, respectivement pour le Mono, l’Ouémé et le Niger. Les nématodes (Oxyuris sp., Œsophagostomum sp. et Heterakis sp.) et les coccidies (Eimeria sp.) sont identifiés. Les fréquences d’infestations singulières ou croisées des sujets sont les suivantes : Eimeria sp. (25,9%), Eimeria sp. et Oxyuris sp. (25,2%), Oxyuris sp. (20,0%), Eimeria sp. et Heterakis sp. (2,96%), Eimeria sp. et Œsophagostomum sp. (2,22%), Œsophagostomum sp. (1,48%) puis Heterakis sp. et Oxyuris sp. (0,74%). Un taux d’infestation de 20,7% de grenouilles moyennement infestés contre 54,81% fortement infestés est obtenu avec un niveau d’infestation variant de façon significative d’un bassin à un autre. Les taux d’infestation sont respectivement de 80,4%, 68,9% et 86,4% dans le côlon, l’intestin grêle et ces deux organes pris simultanément. La proportion des sujets adultes infestés (87,5%) est significativement supérieure à celle des juvéniles (61,7%).
Mots clés: Grenouille, Hoplobatrachus occipitalis, comestible, parasites
Téléchargements
Introduction
En élevage, les parasites, notamment ceux du tractus digestif engendrent d’importantes pertes économiques liées à la réduction des performances zootechniques, à l’altération de la qualité et la diminution de la valeur marchande des animaux (Fabiyi, 1987 ; Kaboré et al., 2006; Mensah et al., 2006). Les strongyloses gastro-intestinales perturbent la croissance, engendrent des mortalités, constituent un obstacle sanitaire important et peuvent représenter un frein au développement de l'élevage (Barré et Moutou, 1982). Chez les petits ruminants, les pertes zootechniques globales causées par les strongyloses digestives ont été évaluées à 33% (Faugère et al., 1991) ou même à plus de 50% (Mahieu et al., 2020). L’étude des parasites des animaux d’élevage et même sauvages mérite l’attention de la recherche scientifique dans la mesure où certains de ces parasites sont peuvent aussi infester les Hommes consommateurs, causant ainsi des maladies appelées zoonotiques (Cama et al., 2003 ; Xiao et Feng, 2008). Dans le domaine des pêches et de l’aquaculture, en dehors des poissons connus par tous, les grenouilles sont aussi consommées dans plusieurs ménages en Afrique. Elles font partir des espèces élevées en aquaculture depuis longtemps (Czudek, 2001). Même s’il a été rapporté que l’élevage de la grenouille n’a pas encore connu un succès perceptible en Afrique (Czudek, 2001), sa chair y est très consommée (Onadeko et al., 2011), dans plusieurs pays à l’instar du Bénin (Mohneke et al., 2010). Les maladies causent des mortalités chez les grenouilles jusqu’au point d’être la principale cause du déclin des populations d’amphibiens (Schloegel et al., 2006). L’implication des parasites et autres agents pathogènes dans la diminution des populations d’amphibiens a été démontré (Daszak et al., 2003). En effet, des espèces de cestodes et trématodes ont été indiquées comme responsables des lésions gastro-intestinales, des déformations de membres et des mortalités élevées dans les populations de grenouilles sauvages (Johnson et al., 2007; Wright, 2006, cité par Blé et al., 2019). La réussite de la raniculture en Afrique pourrait dépendre du niveau de connaissance et de maitrise des questions d’ordre sanitaire dont les helminthoses digestives, entre autres, chez les espèces de grenouille élevées. Ainsi, l’inventaire des endoparasites des amphibiens a été effectué dans plusieurs pays d’Afrique de l’Ouest, dans diverses zones agroécologiques (Aisien et al., 2001, 2003, 2004, 2015; Akani et al. 2011; Imasuen et al., 2012; Edo-Taiwo et al., 2020). Toutefois, aucune de ces précédentes études n’a porté spécialement sur les espèces de grenouilles comestibles, donc ayant un intérêt socio-économique considérable. En Côte d’Ivoire, les travaux de Blé et al. (2019) ont été effectués sur la grenouille comestible Hoplobatrachus occipitalis (Günther, 1858), qui représente l’espèce la plus appréciée par les consommateurs africains (Kouamé et al., 2015).
Notre étude a porté sur cette espèce de grenouille comestible, la plus répandue en Afrique de l'Ouest (Blé et al., 2016; Douglas et Amuzie, 2017) et qui appartient à l’Ordre des Anoures, au Sous Ordre des Salésiens et à la Famille des Dicroglossidae. Selon Hirschfeld et Rode (2011), dans le milieu naturel, H. occipitalis mesure entre 6,8 et 10,8 cm avec une masse corporelle comprise entre 24 et 176 g. Selon Godome et al. (2018), elle se nourrit principalement d’insectes, de petits poissons, de crabes, de mollusques, des fragments végétaux mais aussi de ses congénères. Ces mêmes auteurs rapportent de bonnes potentialités aquacoles pour cette espèce, et signalent qu’en conditions d’élevage elle exige une température égale ou supérieure à 28 °C et un pH compris entre 6,2 et 7 pour une croissance optimale. A notre connaissance, aucune étude sur les parasites de cette espèce n’a encore été rapportée au Bénin bien qu’elle soit la grenouille la plus consommée surtout dans les communautés riveraines des zones humides. C’est pour combler ce déficit que la présente étude qui a pour objectif d’évaluer les parasites intestinaux de H. occipitalis a été initiée en perspective à sa promotion dans les exploitations aquacoles.
Matériel et méthodes
Milieu d’étude
La présente étude a été réalisée dans trois bassins hydrographiques sélectionnés au Bénin (Figure 1) : il s’agit du bassin du Niger situé au Nord puis ceux du Mono et de l’Ouémé au Sud du pays. Pour le bassin frontalier du Niger, les échantillonnages ont été effectués dans les zones humides de la commune de Karimama, villages de Bello-Tounga, de Bomi-Tounga, de South-Touga et de Goungoun Béri; dans le bassin de l’Ouémé, ils ont été effectués dans les communes de Dangbo (Kessounou), d’Adjohoun (Agonli Lowé et Akpadanou), tandis que les villages de Agbobada, Athiémé Centre dans la commune d’Athiémé et celui de Ouedémé dans la commune de Lokossa ont servi de sites de prélèvements pour le compte du bassin du Mono. Les coordonnées géographiques des différents points de prélèvement échantillonnés par bassin sont consignées dans le tableau 1.
Tableau 1: Coordonnées géographiques des sites de prélèvement par bassin

Matériel animal
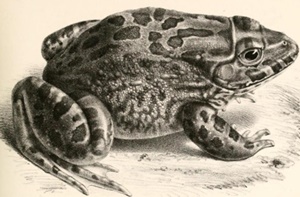
Le matériel animal était constitué d’un échantillon de 135 sujets de H. occipitalis (Figure 2) collectés dans les bassins hydrographiques du Niger au Bénin, de l’Ouémé (delta de l’Ouémé) et du Mono au Bénin à raison de 45 grenouilles par bassin. Le poids moyen des sujets était de 49,8 ± 17,0 g pour une longueur moyenne de 8,6 ±0,9 cm dans le bassin du Niger; de 143,9 ± 31,4 g pour une longueur moyenne de 11,3 ± 0,8 cm dans le bassin de l’Ouémé; et de 87,9 ± 20,5 g pour une longueur moyenne de 10,5 ± 0,8 cm dans le bassin du Mono.
Figure 1: Sites de prélèvement de H. occipitalis dans les trois bassins hydrographiques

Figure 2: Spécimen de Hoplobatrachus occipitalis (Günther, 1858); extrait de Godome et al. (2018)

Collecte et conservation des échantillons
Les grenouilles ont été capturées au moyen de filets (maille de 5-10 mm) dans différents habitats (mares et affluents) respectivement dans les bassins du Mono, de l’Ouémé et du fleuve Niger au Bénin. Après la capture, les individus appartenant à l’espèce d’H. occipitalis ont été identifiés à l'aide des clés d’identification établies par Rodel (2000), Rodel et Branch (2003), et Rodel et al. (2005). Ces grenouilles ont été transférées vivantes au Laboratoire de Diagnostic Vétérinaire et de Sérosurveillance (LADISERO) de Parakou. Elles ont été euthanasiées, disséquées et les contenus de leurs intestins ont été recueillis dans des boîtes de pétri stériles, préalablement étiquetées (date de prélèvement, origine des prélèvements, organes prélevés) puis analysés. Les échantillons ont été conservés à + 4 °C durant la période de leur examen.
Traitement des échantillons collectés
La technique de coproscopie quantitative de Marc Master a été utilisée pour analyser ces échantillons d’intestins. Il s’agit d’une technique qui vise le dénombrement des œufs contenus dans un gramme de fèces: on parle d’Œufs Par Gramme (OPG). Cette technique est basée sur l’utilisation de la lame de Mac Master, composée de deux compartiments contigus séparés par une cloison, chacun d'entre eux ayant un volume de 0,15 ml (Figure 3).
Figure 3: Schéma et photographie d'une lame de Mac Master (Bathiard et Vellut, 2002).

Le protocole expérimental utilisé est celui décrit par Thienpont et al. (1995) avec quelques modifications. Après avoir prélevé 1 g de fèces et/ou de contenu intestinal, on y ajoute 14 ml de solution saturée de Chlorure de Sodium (NaCl) afin d’obtenir une dilution de 1/15éme. Cet ensemble (fèces et solution à NaCl) a été broyé et filtré afin de séparer les éléments grossiers. A l’aide d’une pissette, chacun des deux compartiments de la lame de Mac Master a été rempli avec la suspension puis observé au microscope photonique (objectif 10 X), après 5 min d’attente. Le comptage des œufs a été fait seulement à l’intérieur des six (06) cellules de chaque compartiment de la lame de Mac Master. L’ouvrage «Diagnostic de verminose par examen coprologique» de Thienpont et al. (1995) a été le guide principal pour l’identification des œufs de parasites rencontrés.
Traitement des données et paramètres calculés
Les données collectées ont été traitées au moyen du tableur Excel (Office 2013). L’OPG (Œuf Par Gramme) et les différents taux d’infestation ont été les paramètres calculés.
OPG (Œuf Par Gramme)
Sachant que chaque compartiment de la lame de Mac Master a une contenance de 0,15 ml (0,30 ml des deux compartiments de la lame représente une part de 1/50 des 15 ml de suspension préparée), l’OPG a été déterminé par la formule suivante:

OPG=nombre d^' oeufs dans les deux compartiments ×50
Avec la valeur de l’OPG, l’appréciation du niveau d’infestation de l’échantillon examiné a été faite selon la grille suivante :
Si OPG<100: le sujet est faiblement infesté;
Si 100≤OPG<500 le sujet est moyennement infesté;
Si OPG≥500 le sujet est fortement infesté.
Taux d’infestation des grenouilles et par types de parasites
Le taux d’infestation a été calculé suivant la formule:

Taux d^' infestation=(Nombre d^' échantillons positifs×100)/(Nombre total d^' échantillons analysés)
Analyses statistiques des données
Le test de Khi-deux de Pearson a été utilisé pour déterminer le lien entre différentes caractéristiques qualitatives de la population de grenouilles. L’analyse de variance à un seul facteur (ANOVA 1) a été également effectuée pour mesurer la variation de l’OPG suivant quelques variables qualitatives de la population. Ces différentes analyses statistiques ont été effectuées à l’aide du logiciel IBM SPSS Statistics 21. Le seuil de signification considéré est 5% ou 10%.
Résultats
Listes des parasites rencontrés dans les trois bassins hydrographiques considérés
Deux classes de parasites ont été rencontrées durant la présente étude chez H. occipitalis (Tableau 2). Il s’agit des Nématodes (Oxyuris sp., Œsophagostomum sp. et Heterakis sp.) et des Coccidies (Eimeria sp.).
Tableau 2: Parasites identifiés par bassin hydrographique chez H. occipitalis collecté au Bénin

L’analyse coprologique de fèces des grenouilles du bassin du Mono a montré une forte diversité de parasites par rapport aux deux autres bassins (Tableau 2).
Taux d’infestation et types de parasites rencontrés par organe
Dans le tableau 3 sont présentés les taux d’infestation et les valeurs moyennes de l’OPG par organe pour l’ensemble des grenouilles analysées.
Tableau 3: Taux d’infestation des organes analysés et OPG chez H. occipitalis collecté au Bénin

Les analyses coprologiques (Tableau 3), ont révélé 106 échantillons porteurs d’œufs de parasites sur les 135 traités, soit un taux d’infestation de 78,52% avec un OPG moyen de 629,26 ± 562,99. Les échantillons d’intestin grêle ont été moins infestés (68,89%) par rapport aux échantillons de côlon dont 80,43% ont été porteurs d’œufs de parasites. L’analyse simultanée des échantillons composés de ces deux organes a montré un taux d’infestation de 86,36%. Le taux de positivité n’a pas varié significativement en fonction de l’organe ciblé (khi-2 = 4,180; ddl = 2; p = 0,124) mais la variation de la valeur moyenne de l’OPG a été significative d’un organe à un autre (F = 9,470; ddl = 2; p = 0,000).
La répartition des différents parasites dans les intestins est présentée dans le Tableau 4. Il ressort que la répartition des parasites n’est pas fonction des organes prélevés (P˃0,05).
Tableau 4: Parasites isolés par organe examiné chez H. occipitalis collecté au Bénin

Taux d’infestation par bassin hydrographique d’échantillonnage des grenouilles
Dans le tableau 5 sont présentés les taux d’infestation des grenouilles et les valeurs moyennes de l’OPG en fonction des bassins hydrographiques.
Tableau 5: Taux d’infestation des grenouilles par bassin d’échantillonnage au Bénin et OPG

Les taux d’infestation indiqués dans le Tableau 5 varient d’un bassin à un autre de manière significative (khi-2 = 7,993; ddl = 2; p = 0,018). A l’instar du taux d’infestation, la variation de l’OPG par site de prélèvement est significative (F = 5,184; ddl = 2; p = 0,007).
Parasites isolés par bassins et par classe d’âge
Les taux de prévalence globale des parasites identifiés lors de cette étude sont présentés dans le tableau 6.
Tableau 6: Prévalence globale des parasites dans la zone d’étude au Bénin

Les nématodes et coccidies ont été respectivement identifiés chez 53,33% et 56,29% de la population. Dans le rang des nématodes, les Oxyuris sp. ont été les plus fréquents tandis que les Heterakis sp. et Oesophagostomum sp. ont parasité seulement 3,70% chacun dans la population étudiée (Tableau 6).
L’infestation singulière par Emeria sp. et Oxyuris sp. a été la plus dominante respectivement dans les bassins du Niger (33,33%) et de l’Ouémé (31,11%) alors que, dans le bassin du Mono, c’est l’infestation croisée par ces deux types de parasites qui est dominante (28,89%). Aucune infestation singulière par Heterakis sp. n’a été observée (Figure 4).
Figure 4: Prévalence des parasites intestinaux isolés chez H. occipitalis dans les différents bassins hydrographiques au Bénin

Les sujets adultes de H. Occipitalis ont été parasités par tous les quatre types de parasites identifiés au cours de cette étude alors qu’aucun juvénile n’a été parasité par Oesophagostomum sp. (Figure 5). Même si 50% des adultes ont été parasités par Oxyuris sp., plus de la moitié (65,91%) de cette classe d’âge a été infestée par les coccidies. Emeria sp. et Oxyuris sp. ont infesté à part égale (38,30%) de juvéniles.
Figure 5: Prévalence des parasites intestinaux isolés chez les juvéniles et adultes de H. occipitalis au Bénin

Types de parasitisme et niveaux d’infestation parasitaire des grenouilles par bassin, sexe et classe d’âges
Des 135 grenouilles examinées pour les parasites intestinaux, 47,41% ont été infestées par un seul parasite (soit Eimeria sp. ou Oxyuris sp. ou Œsophagostomum sp.) contre 31,11% de grenouilles polyparasitées. En dehors du bassin du Mono où la fréquence des individus polyparasités est supérieure à celle des monoparasités, le monoparasitisme a été plus observé dans les deux autres bassins, aussi bien suivant le sexe que dans les différentes classes d’âge. Toutefois, le type de parasitisme de la grenouille n’est significativement lié ni au bassin d’origine (khi-2 = 4,201; ddl = 2; p = 0,122), ni au sexe de la grenouille (khi-2 = 0,094; ddl = 2; p = 0,954), ni à sa classe d’âge (khi-2 = 1,231; ddl = 1; p = 0,267). Les fréquences des types de parasitisme sont présentées dans la figure 6.
Figure 6: Fréquence des deux types de parasitisme chez H. occipitalis collecté au Bénin

Le bassin du Mono est caractérisé par une forte proportion de grenouilles fortement parasitées (68,89%, OPG˃500) et une faible fréquence de grenouilles faiblement parasitées. Une similarité du niveau d’infestation a été observée dans les bassins du Niger et de l’Ouémé. Dans l’ensemble des trois bassins, le niveau d’infestation par les parasites intestinaux n’est pas significativement lié à la provenance des grenouilles (khi-2 = 9,258; ddl = 4; p = 0,055).
En considérant le sexe, l’OPG moyen déterminé a été respectivement de 639,44 ± 631,15 et 617,97 ± 480,94 chez les femelles et les mâles. On observe qu’il existe un taux relativement élevé de grenouilles mâles fortement et moyennement parasitées par rapport aux femelles dont 29,58% sont faiblement parasitées. Mais le sexe n’influence pas significativement la valeur moyenne de l’OPG (F=0,049; ddl=1; P=0,826), ni le niveau d’infestation de la grenouille (khi-2 = 2,240; ddl = 2; p = 0,326).
L’OPG moyen des juvéniles a été de 417,02 ± 483,00 alors qu’il s’élève à 742,61 ± 572,28 chez les grenouilles adultes; avec une différence significative (F=11,013; ddl=1; P=0,001). Quant au niveau d’infestation, il dépend significativement de l’âge de la grenouille (khi-2 = 15,991; ddl = 2; p = 0,000). Il est élevé chez une majorité des adultes (62,50%) tandis que près de la moitié des juvéniles (44,63%) est faiblement parasitée. La Figure 7 présente la répartition des sujets par bassin, par sexe et par classe d’âge en fonction du niveau de leur charge parasitaire.
Figure 7: Niveau d’infestation de H. occipitalis collecté au Bénin par bassin hydrographique, sexe et classe d’âges

Discussion
La présente étude a révélé la présence d’œufs de parasites chez 78,52% de la population de Hoplobatrachus occipitalis, avec une forte intensité d’infestation des sujets (OPG moyen de 629,26 ± 562,99). Ces résultats indiquent le degré de menace associé au parasitisme sur les populations de H. occipitalis dans les bassins hydrographiques étudiés. Ce taux élevé d’infestation des grenouilles pourrait être justifié par la qualité, parfois médiocre, de l’eau dans laquelle elles résident (Galli et al., 2001). En effet, les habitats de vie des grenouilles sont généralement alimentés par des eaux de ruissellements capables de drainer des larves de parasites des surfaces terrestres jusqu’au milieu aquatique. Le régime alimentaire de la grenouille étant essentiellement insectivore (Godome et al., 2018), les proies qu’elle consomme peuvent également être des vecteurs de parasites (Moravec et Skorikova, 1998) justifiant ainsi ce fort taux d’infestation constaté dans cette étude. Ce taux d’infestation de 78,52% obtenu dans cette étude est supérieur à celui de 56,6% rapporté par Aisien et al. (2015) après analyse coprologique portant sur 9 espèces de grenouille dont H. occipitalis. Cet écart pourrait être lié au fait que durant les travaux de Aisien et al. (2015), les sujets étudiés ont été pêchés dans le delta du Niger qui constitue une communauté de mangrove, reconnue défavorable à l’infestation par les parasites. Un taux d’infestation de 56,5% a été aussi rapporté par Edo-Taiwo et al. (2020) chez H. occipitalis au Nigéria. Nos résultats se rapprochent cependant de ceux de Aisien et al. (2017) qui ont obtenu une prévalence d’infestation globale de 67,4% chez les anoures en Afrique de l’Ouest où la totalité de certaines espèces ont été infestés. Pour la même espèce, une prévalence de 82,0% a été obtenue par Blé et al. (2019) en Côte d’Ivoire, ce qui n’est pas loin des 78,52% obtenus dans la présente étude.
Notre étude a permis d’identifier 4 types de parasites dans les intestins de H. occipitalis : trois nématodes et une coccidie avec l’absence des cestodes et trématodes. Il s’en déduit que la faune parasitaire de H. occipitalis est peu diversifiée dans les zones d’étude. Toutefois, les précédentes études (Aisien et al., 2017, 2015 ; Edo-Taiwo et al., 2020, Imasuen et al., 2012) ont signalé l’infestation des grenouilles par des nématodes, cestodes, trématodes, etc. Ceci peut être dû au fait que les études de ces auteurs ont porté sur plusieurs espèces de grenouilles, gage potentiel de l’augmentation de la diversité parasitaire aussi bien en termes d’espèces et de groupes (respectivement 10, 13, 17, 19 espèces de parasites). Néanmoins, il est primordial de signaler que plusieurs études ont révélé une prédominance des nématodes dans les parasites des grenouilles (Aisien et al., 2001, 2003, 2004, 2015 ; Edo-Taiwo et al., 2020). L’étude de la prévalence des cestodes chez les anoures en Côte d’Ivoire n’a révélé qu’un taux d’infestation de 3,4% où aucun sujet de H. occipitalis n’a été détecté positif à cette classe de parasite (Oungbe et al., 2019). De même, les travaux de Aisien et al. (2015) ont montré l’absence des cestodes, la présence d’une espèce de trématodes et quatre espèces de nématodes chez H. occipitalis. Akani et al. (2011) ont identifié une espèce de cestodes et de trématodes suivies de deux espèces de nématodes chez H. occipitalis au Nigéria. Ces différents résultats rapportés sont en accord avec ceux obtenus durant notre étude. Chez la même espèce, en Côte d’Ivoire, Blé et al. (2019) n’ont isolé que 4 espèces de parasites: 2 nématodes et 2 trématodes dans les intestins et poumons de la grenouille. Cette faible diversité des parasites est en phase avec nos résultats. La présence des espèces de trématodes dans l’étude de Blé et al. (2019) peut être liée à la différence des organes analysés et la technique coprologique utilisée. Dans notre étude, la prédominance de l’infestation de la grenouille H. occipitalis par les nématodes pourrait s’expliquer par le fait que les eaux qui alimentent les bassins hydrographiques étudiés sont généralement chargées de déjections d’animaux, tels que les petits ruminants qui sont principalement infestés par des nématodes (Barré et Moutou, 1982 ; Aumont et al., 1997 ; Achi et al., 2003 ; Bodji et al., 2017 ; Douglas et Amuzie, 2017).
Nos résultats ont révélé que les taux d’infestation et l’OPG moyen des sujets sont significativement différents d’un bassin à un autre. Ces résultats sont contraires à ceux de Blé et al. (2019) qui n’ont trouvé aucune différence significative entre la prévalence et le site d’échantillonnage. Dans notre étude, cette différence pourrait s’expliquer par les conditions agro écologiques qui varient d’un bassin à un autre. En effet, les sujets provenant du bassin du Mono ont été simultanément plus infestés (91,11%,), avec d’importantes valeurs de l’OPG (824,44 ± 536,15) et ont présenté une diversité parasitaire élevée que ceux issus du bassin de l’Ouémé qui ont été eux aussi plus infestés que ceux du bassin du Niger. De plus, le polyparasitisme a été plus prononcé dans le bassin du Mono (46,67%) avec 68,89% des grenouilles fortement parasitées.
La présente étude a montré une prévalence de 45,93% pour Oxyuris sp. Ce résultat est similaire à celui obtenu par Akani et al. (2011) qui ont observé une prévalence de 45,42% de Oxyuris sp. chez H. occipitalis au Nigéria. L’identification de Eimeria sp. chez H. occipitalis est en accord avec les travaux de Jirku et Modry (2007). L’Heterakis sp. identifié dans cette étude chez H. occipitalis parasite également des animaux domestiques dont la volaille (Bussieras et Chermette, 1992 ; Zenner, 2005). En effet, Heterakis sp. pond des œufs très résistants dans le milieu extérieur qui pourraient être ingérés et véhiculés par des vers de terre (Zenner, 2005) et transmis à la grenouille par voie trophique. Ainsi, l’identification de ce parasite chez les grenouilles du bassin du Mono pourrait toujours s’expliquer par la présence des déjections animales dans les zones humides. Aussi, la présence de nodules d’œsophagostomose et des œufs d’Oesophagostomum sp., parasite intestinal des ruminants, du porc et des primates, serait-elle due au fait que ce parasite est reconnu endémique au Nord du Togo (Guillot et al., 2011), région partageant le bassin du mono avec le Bénin.
Malgré la variation significative de l’OPG moyen de la grenouille d’un bassin à un autre, les niveaux d’infestation n’ont pas été significativement influencés par la provenance des grenouilles. Ce résultat pourrait s’expliquer par le fait que la variable « niveau d’infestation » ne reflète pas la charge réelle de l’infestation et n’est qu’un regroupement des valeurs d’OPG selon des intervalles bien définis.
Par ailleurs, la présente étude a permis de constater que le type de parasitisme intestinal, la valeur moyenne de l’OPG ainsi que le niveau d’infestation parasitaire ne sont pas significativement liés au sexe de la grenouille. Ces résultats corroborent ceux de Blé et al. (2019) qui n’ont pas trouvé de différence significative entre la prévalence et l’intensité moyenne d’infestation selon le sexe chez H. occipitalis en Côte d’Ivoire. Suivant les OPG moyens observés par classe d’âge, les juvéniles ont été moyennement infestés tandis que les adultes, fortement parasités. Il a été constaté la présence d’Oesophagostomum sp. dans la classe des adultes alors que ce parasite est absent chez les juvéniles.
Conclusion
La présente étude a permis de constater que l’infestation digestive de la grenouille Hoplobatrachus occipitalis est très peu diversifiée, avec une prédominance du monoparasitisme dans les bassins hydrographiques du Mono, de l’Ouémé et du Niger au Bénin. Elle est représentée par une espèce de coccidies (Eimeria sp.) et trois espèces de nématodes (Oxyuris sp., Œsophagostomum sp., Heterakis sp.). La prévalence de ces parasites chez cette espèce de grenouille est élevée (78,52%) et accompagnée d’une forte infestation des sujets, indépendamment de leur provenance géographique. Ces résultats ont donc permis de connaitre pour la première fois le statut infestueux de cette espèce dans différents bassin hydrographiques du Bénin. Cette information est d’une importance capitale pour le choix de l’origine des sujets à promouvoir dans les exploitations aquacoles du Bénin. En perspective il urge de mieux documenter la faune parasitaire des grenouilles au Bénin.
Références bibliographiques
Achi, Y. L., Zinsstag, J., Yeo, N., Dea, V., & Dorchies, P. H. (2003). Epidémiologie des helminthoses des moutons et des chèvres dans la région des savanes du Nord de la Cote d'Ivoire. Revue de médecine vétérinaire, 154(3), 179-188.
Aisien, S. O., Ugbo, A. D., Ilavbare, A. N., & Ogunbor, O. (2001). Endoparasites of amphibians from south-western Nigeria. Acta Parasitologica, 46(4), 299-305.
Aisien, S. O., Ajakaiye, F.B. and Braimoh, K. 2003. Helminth parasites of anurans from the savannah-mosaic zone of south-western Nigeria. Acta Parasitologica, 48(1), 47-54.
Aisien, S. O., Ayeni, F and Ilechie, I. 2004. Helminth fauna of anurans from the Guinea savanna at New Bussa, Nigeria. African Zoology, 39 (1), 133-136.
Aisien, M. S. O., Uwagbae, M., Edo-Taiwo, O., Imasuen, A. A., & Ovwah, E. (2015). Pattern of parasitic infections in anurans from a mangrove community of the Niger Delta, Nigeria. The Zoologist, 13(1), 51-56.
Aisien, M. S. O., Sampson, S. A., & Amuzie, C. C. (2017). Parasitic infections of anurans from an urbanized rainforest biotope in Diobu, Port Harcourt, Nigeria. Nigerian Journal of Parasitology, 38(2), 292-297.
Akani, G. C., Luiselli, L., Amuzie, C. C., & Wokem, G. N. (2011). Helminth community structure and diet of three Afrotropical anuran species: a test of the interactive-versus-isolationist parasite communities hypothesis. Web ecology, 11(1), 11-19.
Aumont, G., Pouillot, R., Simon, R., Hostache, G., Varo, H., & Barré, N. (1997). Parasitisme digestif des petits ruminants dans les Antilles françaises. Productions animales, 10(1), 79-89.
Barré, N., & Moutou, F. (1982). Helminthes des animaux domestiques et sauvages de La Réunion. Inventaire et rôle pathogène. I. Mammifères. Revue d’élevage et de médecine vétérinaire des pays tropicaux, 35(1), 43-55.
Bathiard, T., & Vellut, F. (2002). Coproscopie parasitaire. Thèses vétérinaires en ligne. [en-ligne], Lyon: Ecole Nationale Vétérinaire de Lyon. Accès internet : http://www. vet-lyon. fr/formatio/copro/index. Htm] (consultée le 15 avril 2021).
Blé, Y. C., Kakou, B. I., Kouadio, K. N., & Komoin, C. (2019). First report of helminths parasites in frog (Hoplobatrachus occipitalis, Günther 1858) from Daloa, Issia and Sinfra (Côte d’Ivoire). International Journal of Fisheries and Aquatic Studies, 7(3), 275-278
Bodji, N. C., Koutouan, F. P., Wandan, E. N., Yapi, Y. M., N’din, N. S., & Iritié, B. M. (2017). Évaluation in vivo des propriétés anthelminthiques des extraits aqueux d’Annona senegalensis. Pers. (Annonaceae) chez les ovins Djallonkés. Journal of Animal and Plant Sciences, 32(2), 5111-5119.
Bussieras, J., & Chermette, R. (1992). Parasitologie Vétérinaire, Protozoologie. Service de Parasitologie ENVA. 172-174.
Cama, V.A., Bern, C., Sulaiman, I.M., Gilman, R.H., Ticona, E., & Vivar, A. (2003). Cryptosporidium species and genotypes in HIV-positive patients in Lima. Journal of Eukaryotic Microbiology, 50, 531-533.
Czudek, R. (2001). Utilisation rationnelle de la faune sauvage en Afrique. Moyen de la conservation, FAO, (1), 41.
Daszak, P., Cunningham, A. A., & Hyatt, A. (2003). Infectious disease and amphibian population declines. Diversity and Distributions, 9, 141-150.
Douglas, S. I., & Amuzie, C. C. (2017). Microbiological quality of Hoplobatrachus occipitalis (Amphibia, Anura) used as meat. International Journal of Current Microbiology and Applied Sciences, 6(6), 3192-3200.
Edo-Taiwo, O., Ominun, O. P., Jibunor, R. O., Ehiagwina, J. C., & Aisien, M. S. O. (2020). Endoparasites in six anuran species from a changing rainforest biotope in Edo State, Southern Nigeria. Nigerian Journal of Parasitology, 41(2). 251-259.
Galli, P., Crosa, G., Mariniello, L., Ortis, M., & D'amelio, S. (2001). Water quality as a determinant of the composition of fish parasite communities. Hydrobiologia, 452(1), 173-179.
Godome, T., Tossavi, E., Ouattara, N. I., & Fiogbe, E. D. (2018). Bibliographic synthesis on biology and ecology of Hoplobatrachus occipitalis (Günther, 1858). International Journal of Biological and Chemical Sciences, 12(3), 1484-1493.
Guillot, J., Vermeulen, B., Lafosse, S., Chauffour, S., Cibot, M., Narat, V., Masi, S., Nieguitsila, A., Snounou, G., Bain, O., & Krief, S. (2011). Les nématodes du genre Oesophagostomum. Un risque émergent pour l’homme et les grands singes en Afrique ? Bulletin de l'Académie nationale de médecine, 195(8), 1955-1963.
Imasuen, A. A., Enabulele, E. E., & Aisien, M. S. O. (2012). Helminth community of tree frogs at the Okomu National Park, Edo State, Nigeria. Nigerian Journal of Parasitology, 33(1). 1-8.
Jirku, M., & Modry, D. (2007). Eimeria terraepokotorum n. sp. (Apicomplexa: Eimeriidae) from Hoplobatrachus occipitalis (Anura: Ranidae) from Kenya. Acta protozoologica, 45(4), 443.
Johnson, P. T., Chase, J. M., Dosch, K. L., Hartson, R. B., Gross, J. A., Larson, D. J., Sutherland, D. R., & Carpenter, S. R. (2007). Aquatic eutrophication promotes pathogenic infection in amphibians. Proceedings of the National Academy of Sciences, 104(40), 15781-15786.
Kabore, A. (2006). Parasites gastro-intestinaux des zébus laitières de races azawak et peul soudanien en zone nord soudanienne du Burkina-Faso : évolution en saison humide. DEA, Institut du développement rural, Département Élevage, Université polytechnique de Bobo-Dioulasso, 39.
Kouamé, N. G., Ofori-Boateng, C., Adum, G. B., Gourène, G., & Rödel, M. O. (2015). The anuran fauna of a West African urban area. Amphibian and Reptile Conservation, 9(2), 1-14.
Mensah, G. A., Sobakin, L. J., Koudande, D., Pomalegni, C. B., & Kpera, G. N. (2006). Inventaire préliminaire des plantes médicinales utilisées pour traiter les aulacodes d’élevages malades et pour la prophylaxie sanitaire dans les aulacodicultures installés au Sud-Bénin. Bulletin de la Recherche Agronomique du Bénin, 54, 19-20.
Mohneke, M., Onadeko, A. B., Hirschfeld, M., & Rödel, M. O. (2010). Dried or fried: amphibians in local and regional food markets in West Africa. Traffic Bulletin, 22(3), 117-128.
Moravec, F., & Skorikova, B. (1998). Amphibians and larvae of aquatic insects as new paratenic hosts of Anguillicola crassus (Nematoda: Dracunculoidea), a swimbladder parasite of eels. Diseases of aquatic organisms, 34(3), 217-222.
Onadeko, A. B., Egonmwan, R. I., & Saliu, J. K. (2011). Edible amphibian species: local knowledge of their consumption in southwest Nigeria and their nutritional value. West African Journal of Applied Ecology, 19(1), 67-76.
Oungbe, K. V., Kouame, K. A., N’zi, K. G., Goore-BI, G., & N’douba, V. (2019). Inventaire et Prévalence des Cestodes Parasites des Anoures dans Trois Zones agro-Industrielles au Sud-Est de la Côte d’Ivoire. European Journal of Scientific Research, 153(2), 165-175
Rodel, M.O. (2000). Herpetofauna of West Africa, Vol. 1: Amphibians of the West African savanna. Edition Chimaira, Frankfurt/M, 1, 335.
Rodel, M. O., & Branch, R. (2003). Herpetological survey of the haut Dodo and carally forests, western Ivoiry cost, Part 1 Amphibians. Salamandra, 38, 213-232.
Rodel, M. O., Gil, M., Agyei, A. C., Leache, A. D., Diaz, R. E., Fujita, M. K., & Ernst. (2005). The Amphibians of the forested parts of southwestern Ghana. Salamandra, 41, 107-127.
Schloegel, L. M., Hero, J. M., Berger, L., Speare, R., McDonald, K., & Daszak, P. (2006). The decline of the sharp-snouted day frog (Taudactylus acutirostris): the first documented case of extinction by infection in a free-ranging wildlife species. EcoHealth, 3(1), 35-40.
Thienpont, D., Rochette, F., & Vanparijs, O.F.J. (1995). Diagnostic de Verminoses par examen Coprologique. Jansen Research Fondation, Beerse, Belgique, 205.
Wright, K. M. (2006). Overview of amphibian medicine. Reptile medicine and surgery, 2, 941-971.
Xiao, L., & Feng, Y. (2008). Zoonotic cryptosporidiosis. FEMS Immunology and Medical Microbiology, 52(3), 309-323.
Zenner, L. (2005). Données actuelles sur l'infection à Histomonas meleagridis chez les volailles. Bulletin de l'Académie vétérinaire de France, (2), 161-166.
Publié-e
Comment citer
Numéro
Rubrique
Licence

Revue Marocaine des Sciences Agronomiques et Vétérinaires est mis à disposition selon les termes de la licence Creative Commons Attribution - Pas d’Utilisation Commerciale - Partage dans les Mêmes Conditions 4.0 International.
Fondé(e) sur une œuvre à www.agrimaroc.org.
Les autorisations au-delà du champ de cette licence peuvent être obtenues à www.agrimaroc.org.

